La Constante de Faraday es una constante física descubierta por el químico Michael Faraday en 1834. Esta constante es una de las constantes básicas en la química y se usa para calcular los cambios en la energía química que se producen durante una reacción química. Esta constante es igual a 96485 Coulombs por mol. Esta constante se usa para calcular la cantidad de electricidad necesaria para reducir un mol de un ion a un estado neutro. Esta constante también se usa para calcular la cantidad de electricidad necesaria para oxidar un mol de una sustancia. Esta constante se usa para calcular la cantidad de energía necesaria para generar un mol de un producto químico a través de una reacción química. Esta constante también se usa para calcular la cantidad de energía necesaria para cambiar la temperatura de una solución química. Esta constante se utiliza para calcular la cantidad de electricidad necesaria para neutralizar un mol de ácido o una base. Finalmente, esta constante se usa para calcular la cantidad de energía necesaria para producir una reacción química entre dos moléculas.
Valor constante de Faraday
La Constante de Faraday es una constante física que mide la cantidad de electricidad que una determinada sustancia absorbe o libera cuando se somete a una reacción química. Se llama así en honor al científico Michael Faraday. Esta constante se expresa como F, y su valor es de 96500 C / mol. Esta constante es una medida de la cantidad de electricidad que se necesita para producir una molécula de una determinada sustancia química.
La Valor constante de Faraday es una importante unidad de medición en la química y la física. Esta constante mide la cantidad de electricidad que se necesita para producir una molécula de una sustancia química específica. Esta constante se utiliza para medir la cantidad de energía que se necesita para realizar una reacción química. Esta constante es esencial para la comprensión de la química, ya que se utiliza para medir la cantidad de electricidad que se necesita para producir una molécula de una sustancia química. El valor constante de Faraday es 96500 C / mol.
Otras unidades comunes
Otras unidades comunes en la Física son la unidad de Coulomb (C), la unidad de voltio (V), la unidad de ohmio (Ω) y la Constante de Faraday (F).
La Constante de Faraday es una unidad de electricidad y se expresa como F. Su valor es de aproximadamente 96485.3399 C / mol. Esta constante se usa para medir la cantidad de electricidad necesaria para producir una reacción química. Se utiliza para calcular la cantidad de electricidad que se necesita para producir una reacción química específica, como la oxidación de un metal.
La Constante de Faraday también se usa para calcular la cantidad de electricidad que se necesita para producir una reacción química específica, como la oxidación de un metal. Por ejemplo, para la oxidación de hierro, se requieren aproximadamente 96485.3399 C de electricidad. Esto significa que se necesitan 96485.3399 C de electricidad para oxidar un mol de hierro. Esta es una aplicación práctica de la Constante de Faraday.
Además, la Constante de Faraday también se utiliza para calcular la cantidad de electricidad que se necesita para producir una reacción química específica, como la reducción de un metal. Por ejemplo, para la reducción de hierro, se requieren aproximadamente 96485.3399 C de electricidad. Esto significa que se necesitan 96485.3399 C de electricidad para reducir un mol de hierro. Esta es otra aplicación práctica de la Constante de Faraday.
En resumen, la Constante de Faraday es una unidad de electricidad que se expresa como F. Se utiliza para calcular la cantidad de electricidad que se necesita para producir una reacción química específica, como la oxidación o la reducción de un metal. Su valor es de aproximadamente 96485.3399 C / mol. Esta constante es extremadamente útil en la Física y es una de las unidades comunes utilizadas en el campo.
Fórmula constante de Faraday
Fórmula constante de Faraday: es una constante física de gran importancia para los cálculos relacionados con la electroquímica. Esta constante fue descubierta por Michael Faraday y se conoce como la constante de Faraday. Esta constante se utiliza para calcular la cantidad de electricidad que fluye a través de una celda electroquímica. La constante de Faraday se expresa como una cantidad de electricidad igual a una cantidad de carga igual a la carga de un mol de electrones. Esta constante es igual a 96.485 kJ/V·mol. Esta fórmula se usa para calcular la cantidad de electricidad que fluye a través de una celda electroquímica para producir una corriente determinada. Esta constante también se utiliza para calcular la cantidad de electricidad que se produce durante una reacción química.
Aplicaciones
Las Aplicaciones de la Constante de Faraday en Física son múltiples ya que esta constante se utiliza ampliamente para predecir y entender los procesos físicos dentro de la ciencia. Esta constante fue descubierta por el científico inglés Michael Faraday en 1834, y desde entonces ha sido un tema de interés para la física. La Constante de Faraday se define como el número de unidades de electricidad que deben pasar a través de un conductor para producir una cantidad de unidades de carga. Esta constante se usa para calcular la cantidad de electricidad producida en una célula electroquímica, como una batería, y se usa para determinar la cantidad de energía cinética creada en un dispositivo como un motor eléctrico. Esta constante también se usa para predecir la corriente eléctrica producida por la inducción magnética, lo que hace que sea una herramienta útil en el estudio de la electromagnetismo. Además, la Constante de Faraday es una herramienta útil en la investigación de la energía nuclear, ya que se usa para calcular la cantidad de energía producida por una reacción nuclear. Por último, la Constante de Faraday se usa para determinar la velocidad a la que una carga eléctrica se desplaza a través de un material aislante. Esto es útil para estudiar la propagación de ondas de radio.
Cálculo
Cálculo es una rama de las matemáticas que se ocupa de la teoría de las funciones, las derivadas y las integrales. Esta disciplina se aplica a muchas áreas de la ciencia, como la física. En la física, el cálculo se usa para estudiar sistemas dinámicos, como reacciones químicas y procesos físicos. Uno de los conceptos más importantes en el cálculo es la constante de Faraday, que es una cantidad física que se usa para calcular la cantidad de energía necesaria para convertir una cantidad dada de una sustancia a otra. Esta constante también se usa para calcular la cantidad de energía necesaria para mover una carga eléctrica a través de un circuito. Esta constante se encuentra en la ley de Faraday, que dice que la energía liberada en una reacción química es proporcional a la cantidad de carga eléctrica que atraviesa el circuito.
¿Qué es la constante de Faraday?
La constante de Faraday es una constante física cuyo valor es el mismo para todos los materiales y es una de las constantes fundamentales de la electricidad. Se denomina así en honor al científico inglés Michael Faraday. Esta constante se expresa como una cantidad de electricidad en Coulombs por mol de electrones, y su valor es igual a 96500 Coulombs por mol. Esta constante se utiliza en muchos de los cálculos relacionados con la electricidad, incluyendo la ley de Faraday y la ley de Ohm.
La constante de Faraday es una constante importante en la física de la electricidad, ya que se utiliza para calcular la cantidad de electricidad que se necesita para mover una carga eléctrica a través de un circuito. Esta cantidad se conoce como flujo de corriente eléctrica. La ley de Faraday se basa en la relación entre el flujo de corriente y la constante de Faraday, y establece que la cantidad de electricidad que se mueve a través de un circuito es igual al producto de la constante de Faraday y el número de moles de electrones que se mueven a través del circuito.
Además, la constante de Faraday también se utiliza para calcular la cantidad de energía que se necesita para mover una carga eléctrica a través de un circuito. Esta energía se conoce como potencia eléctrica y se calcula multiplicando la constante de Faraday por el cuadrado de la diferencia de potencial entre los extremos del circuito. Esta relación se conoce como la ley de Ohm.
Por lo tanto, la constante de Faraday es una constante importante en el campo de la física de la electricidad, ya que se utiliza para calcular el flujo de corriente eléctrica y la cantidad de energía necesaria para mover una carga a través de un circuito.
¿Cuál es el valor de la constante de Faraday?
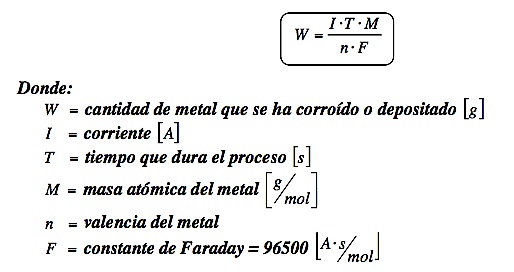
La Constante de Faraday es una constante física utilizada en la electroquímica para calcular los potenciales de reducción o oxidación (cambios de energía) en una reacción química. Esta constante es igual a la cantidad de electricidad (carga) transportada por un mol de electrones. Está representada por la letra F y su valor es de 96500 C/mol (Coulomb/mol). Esta cantidad de electricidad es igual a un voltio-mol multiplicado por el número de Avogadro (6.022 x 10^23). La Constante de Faraday es utilizada para calcular el cambio de energía en una reacción química, así como en la química de la corrosión. Además, es utilizada para calcular la energía necesaria para mover los iones a través de una membrana líquida, como en una celda electroquímica.
¿Cuál es la fórmula de la constante de Faraday?
La Constante de Faraday es una constante física que se usa para calcular la cantidad de electricidad en una solución electroquímica. Fue descubierta por el científico inglés Michael Faraday en el siglo XIX. La constante de Faraday se define como el número de coulombs (C) por mol (mol) de reactivo: F = N_A × e , donde N_A es el número de Avogadro (6.022 × 10 ^ 23 mol ^ -1) y e es la carga elemental (1,602 × 10 ^ -19 C). Esta fórmula se conoce como la Fórmula de Faraday. La Constante de Faraday es muy importante en la electroquímica y se usa para calcular la cantidad de electricidad que se puede generar en una solución o para determinar la cantidad de reactivo que se necesita para producir cierta cantidad de electricidad.
También se puede usar para calcular el potencial de una reacción electroquímica, ya que es el factor que determina la cantidad de energa necesaria para producir una reacción química. La Constante de Faraday sirve como una herramienta útil para calcular todo tipo de potenciales electroquímicos.
¿Cuál es el valor de la constante de Faraday en kcal por volt gramo equivalente?
La Constante de Faraday es una constante física conocida como la constante de electroquímica que se utiliza para calcular la cantidad de electricidad que se libera o se consume en una reacción química. Esta constante fue descubierta por Michael Faraday, quien también fue el primero en utilizar la palabra «electroquímica». Esta constante se expresa como el número de coulombs por gramo equivalente, y su valor es de 96500 Coulombs por gramo equivalente.
En términos de energía, la Constante de Faraday se expresa como kcal por volt gramo equivalente, y su valor es de 96.485 kcal por volt gramo equivalente. Esta cantidad de energía se utiliza para calcular la energía liberada o consumida en una reacción química. Esta cantidad de energía también se conoce como energía química.
En conclusión, el valor de la constante de Faraday en kcal por volt gramo equivalente es de 96.485 kcal. Esta cantidad de energía se utiliza para calcular la cantidad de energía liberada o consumida en una reacción química.
¿Cuál es la aplicación de la constante de Faraday?
La Constante de Faraday es una constante física importante que fue descubierta por Michael Faraday en 1834. Esta constante se refiere a la cantidad de electricidad necesaria para reducir la cantidad total de carga en una solución. Esta cantidad es igual a la cantidad de electricidad que se necesita para reducir un equivalente gramo de un ion específico en una solución. Esta constante se expresa como una unidad de medida llamada «coulomb-equivalente», que se mide en coulombs.
La aplicación de la Constante de Faraday está relacionada con la química electroquímica. Esta constante se usa para calcular la cantidad de electricidad necesaria para reducir una cantidad específica de un ion específico en una solución. Esto se usa para calcular la cantidad de electricidad necesaria para reacciones químicas electroquímicas, como la oxidación y la reducción. También se usa para calcular la cantidad de electricidad necesaria para producir un equivalente gramo de un metal a partir de su óxido. Esta constante también se usa en la producción de baterías, donde se usa para calcular la cantidad de electricidad que se necesita para producir una carga de una batería. Esta constante también se usa para calcular la cantidad de electricidad necesaria para producir una corriente eléctrica.
Explicación de la ley de inducción electromagnética de Faraday
Ley de inducción electromagnética de Faraday: Esta ley establece que una diferencia de potencial electromotriz, llamada también voltaje, se genera en un circuito cerrado cuando este es sometido a una variación en el campo magnético que lo atraviesa. Esta ley fue propuesta por el científico británico Michael Faraday en 1831.
La constante de Faraday, también llamada constante de electroquímica, es el valor numérico que se usa para calcular la diferencia de potencial electromotriz producida por una variación en el campo magnético. Esta constante se representa con la letra K o F, y su valor numérico es de 96500 C / mol. Esta constante fue propuesta por el mismo Faraday en 1832.
La constate de Faraday es muy importante para entender la ley de inducción electromagnética de Faraday, ya que gracias a ella es posible calcular la energía que se genera en un circuito cerrado cuando este es sometido a una variación en el campo magnético. Esta energía generada en el circuito se conoce como voltaje, y es la energía que se necesita para que los electrones fluyan en el circuito.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.