Electrólisis y galvanoplastia son términos relacionados con la física que se refieren a procesos químicos utilizados para producir cambios en los átomos en soluciones acuosas. La electrólisis implica la aplicación de una corriente eléctrica directa a una solución o disolución líquida, mientras que la galvanoplastia se refiere a la deposición de un metal sobre una superficie metálica utilizando una corriente eléctrica. Ambos procesos se utilizan con frecuencia para refinamientos químicos, y pueden también ser usados para crear aleaciones con un aspecto diferente.
En la electrólisis, los átomos de los iones positivos y negativos de una solución líquida se reacomodan al pasar la corriente eléctrica, lo que resulta en la separación de los iones. Esta reacción química se conoce como descomposición electroquímica, y se pueden llevar a cabo diversas reacciones químicas mediante el uso de diferentes tipos de electrodos.
En la galvanoplastia, una corriente eléctrica se aplica a una solución líquida que contiene un metal en disolución, lo que resulta en la deposición del metal en la superficie de una pieza metálica conectada a un electrodo. Esta técnica se usa con frecuencia para procesos de recubrimiento, y se pueden crear aleaciones con un aspecto diferente al combinar esta técnica con la electroquímica.
¿Qué es la electrólisis?
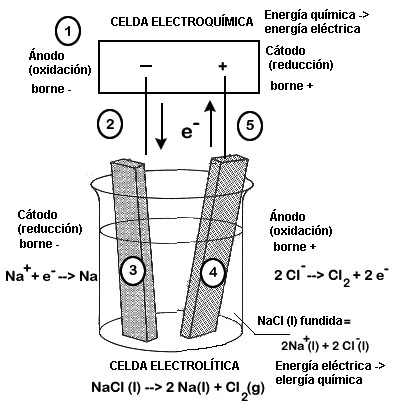
La Electrólisis es un proceso químico por el que se obtiene la descomposición de una solución acuosa, en la que se aplica una corriente eléctrica para separar los iones de una disolución. Esto se logra introduciendo dos electrodos, que pueden ser de materiales diferentes, uno positivo y otro negativo, en un recipiente con una solución acuosa. Cuando se aplica una corriente eléctrica, los iones positivos se desplazan hacia el electrodo negativo, mientras que los iones negativos se mueven hacia el electrodo positivo, lo que resulta en una reacción química.
Electrólisis y Galvanoplastia son dos términos relacionados con la física que se utilizan para describir procesos similares. Mientras que la Electrólisis se refiere a la separación de iones en una solución acuosa mediante la aplicación de una corriente eléctrica, la Galvanoplastia es el proceso de deposición de un recubrimiento metálico sobre un material mediante el uso de una corriente eléctrica. Esto se puede lograr recubriendo un objeto con una solución acuosa de un metal específico, y aplicando una corriente eléctrica para que el metal se deposite en la superficie del objeto.
Proceso de electrólisis
Proceso de electrólisis: Es un proceso químico que se lleva a cabo mediante la aplicación de una corriente eléctrica a una solución electrolítica, que contiene iones disueltos. Se usa para separar un compuesto químico en sus componentes, para oxidar o reducir los iones de una solución, o para sintetizar compuestos químicos a partir de iones disueltos. Esta técnica se puede aplicar tanto a soluciones acuosas como no acuosas.
En el proceso de electrólisis se usa una fuente de energía eléctrica para aplicar una corriente continua a los electrodos sumergidos en la solución. Esta corriente induce una reacción química en la solución, que a su vez separa los iones disueltos en los componentes de la solución. Los iones positivos se dirigen hacia el electrodo negativo, mientras que los iones negativos se dirigen hacia el electrodo positivo.
Electrólisis y galvanoplastia: La galvanoplastia es un proceso en el que se usa la electrólisis para recubrir una superficie con un metal o una aleación. Esta técnica se usa para mejorar la resistencia a la corrosión, para mejorar la apariencia de la superficie, para evitar el desgaste y para mejorar la ductilidad.
En la galvanoplastia se usa un baño de solución electrolítica que contiene iones del metal deseado. Se sumergen dos electrodos en la solución, y se aplica una corriente eléctrica entre los dos. Esto hace que algunos de los iones del metal se depositen en la superficie del objeto que está siendo recubierto. Esta técnica se usa para depositar capas de cobre, níquel, cromo, oro, plata y otros metales.
¿Por qué el aluminio ya no es un metal precioso?
El aluminio ya no es considerado un metal precioso debido a que se ha vuelto mucho más fácil de obtener con los avances tecnológicos. Esto se debe principalmente a la electrólisis y la galvanoplastia, procesos químicos que permiten separar los átomos de los metales preciosos para crear aleaciones y materiales metálicos.
La electrólisis es un proceso químico que separa los átomos de los metales preciosos mediante la aplicación de una corriente eléctrica. Esto permite separar los átomos de los metales preciosos, como el oro y la plata, para crear aleaciones y materiales metálicos. Estos materiales son luego utilizados para hacer objetos como joyas, monedas, electrónica, etc.
La galvanoplastia es un proceso químico que deposita una capa de metal sobre una superficie. Esto se hace mediante la introducción de una corriente eléctrica, lo que permite formar una capa de metal sobre el material base. El aluminio es uno de los metales más utilizados en el proceso de galvanoplastia. La galvanoplastia se utiliza para recubrir superficies metálicas con una capa protectora, como en la industria automotriz, para proteger los vehículos de la corrosión.
Los avances en electrólisis y galvanoplastia han permitido una mayor producción de aluminio, lo que ha hecho que el aluminio ya no sea considerado un metal precioso. Esto se debe a que el aluminio puede ser producido en grandes cantidades y a un precio más bajo que los metales preciosos. El aluminio es ahora uno de los metales más comunes en el mundo, con una amplia variedad de aplicaciones.
Usos de la Electrólisis
Electrólisis: La electrólisis es un método de separación de elementos o compuestos químicos mediante el paso de una corriente eléctrica a través de una solución electroquímica. Esta corriente eléctrica, al penetrar la solución, descompone los compuestos en sus elementos constituyentes. Esta técnica se utiliza en numerosas aplicaciones, desde la producción de cloro hasta la electrodeposición (galvanoplastia) de metales.
Electrólisis y galvanoplastia: La galvanoplastia es un método de recubrimiento de superficies mediante la deposición de un metal por medio de una corriente eléctrica. Se utiliza para aumentar la resistencia a la corrosión, a la abrasión, a la fatiga, y para mejorar la apariencia estética. Esta técnica se basa en la electrólisis, un proceso químico por el cual los iones de una solución se desplazan hacia los electrodos conectados a una fuente de alimentación. Los iones se depositan en la superficie del metal, formando un recubrimiento con las propiedades deseadas.
La galvanoplastia es una técnica muy utilizada en los procesos industriales para la protección de diversas superficies, como la de algunos metales. Por ejemplo, se emplea para recubrir con una capa de oro o plata la superficie de objetos de joyería, para aumentar su resistencia a la corrosión y a la abrasión. También se utiliza para la fabricación de productos electrónicos, como circuitos impresos, y en la construcción de estructuras metálicas.
Mire y aprenda sobre los conceptos básicos del flujo de corriente
Conceptos básicos del flujo de corriente: El flujo de corriente es una forma de energía que se produce cuando una fuerza electromotriz se ejerce sobre un conductor. En la electrónica, el flujo de corriente se refiere a la cantidad de electricidad que se mueve a través de un circuito eléctrico. Esto se debe a que los electrones libres se mueven a través de un conductor debido a la fuerza electromotriz.
Los conceptos básicos del flujo de corriente incluyen resistencia, voltaje y corriente. La resistencia es la medida de la oposición a la que se enfrenta la corriente eléctrica mientras se mueve a través de un material conductor. El voltaje es la medida de la fuerza electromotriz que se aplica para mover la corriente a través de un conductor. La corriente es la cantidad de electricidad que se mueve a través de un conductor por unidad de tiempo.
Relación entre el flujo de corriente y la electrólisis y galvanoplastia: La electrólisis y la galvanoplastia son procesos que se utilizan para alterar la composición de los materiales. Estos procesos se basan en el flujo de corriente. La electrólisis se refiere al proceso de descomponer una solución a través de la aplicación de una corriente eléctrica. Esto se logra mediante la aplicación de un voltaje para mover los iones a través de la solución. La galvanoplastia es un proceso similar al de la electrólisis, pero se utiliza para formar capas de metales sobre una superficie. Esto se logra mediante la aplicación de una corriente eléctrica entre dos electrodos, uno positivo y uno negativo.
¿Qué es la galvanoplastia?
La Galvanoplastia es un proceso electroquímico de recubrimiento metálico, también conocido como metalizado por electrodeposición, que consiste en depositar un metal sobre la superficie de una pieza. El proceso de galvanoplastia se utiliza para proteger una pieza metálica contra la corrosión, para mejorar su resistencia mecánica, para darle un acabado atractivo y para aumentar su conductividad eléctrica. El recubrimiento de metal se deposita por medio de una corriente eléctrica en un baño de electrólisis.
Electrólisis y Galvanoplastia son dos procesos químicos similares, pero con algunas diferencias importantes. La electrólisis es un proceso químico en el que una corriente eléctrica se utiliza para separar los iones de un compuesto en sus elementos constituyentes. La galvanoplastia, por otro lado, es un proceso electroquímico en el que una corriente eléctrica se utiliza para depositar un metal sobre la superficie de una pieza. En la galvanoplastia, los iones metálicos se reducen a partir de una solución electroquímica y se fijan a la superficie para formar el recubrimiento metálico.
¿Cómo funciona la galvanoplastia?
Galvanoplastia: es una técnica de metalurgia química que se usa para depositar un material metálico sobre la superficie de un objeto. Esta técnica se basa en la electrólisis, un proceso en el que se usa electricidad para crear una reacción química. En la galvanoplastia, una corriente eléctrica se aplica a una solución de un metal en forma líquida. Al pasar la corriente eléctrica a través de la solución, el metal se deposita en la superficie del objeto.
La galvanoplastia se usa para crear una capa de metal sobre la superficie de un objeto. Esta técnica se usa comúnmente para recubrir objetos con un metal precioso, como el oro, el plata o el cobre. La galvanoplastia también se usa para aumentar la resistencia a la corrosión de los metales. La capa de metal es muy fina, lo que significa que el metal se adhiere a la superficie sin agregar peso significativo.
La galvanoplastia es un proceso relativamente sencillo y seguro. La única limitación es que la solución de metal debe ser un metal que sea soluble en el líquido y se pueda depositar sobre la superficie. Esto significa que no todos los metales pueden usarse para la galvanoplastia. Además, el objeto debe estar libre de impurezas para que el proceso funcione correctamente.
Chapado en plata:
Chapado en plata es un proceso de recubrimiento que consiste en aplicar una fina capa de plata sobre una superficie de otro metal. Esta técnica se utiliza para mejorar la estética, la resistencia al desgaste y la conductividad eléctrica. El proceso se realiza mediante una técnica llamada galvanoplastia, que se basa en la electrólisis.
En la electrólisis, se aplica una corriente eléctrica a una solución de un compuesto electrolítico, que contiene partículas cargadas. Estas partículas son atraídas hacia los electrodos conectados a la solución, donde se deposita un metal.
En la galvanoplastia, el proceso es ligeramente diferente ya que los electrodos no están conectados a una solución, sino a una superficie metálica. Esta superficie se conecta a una fuente de corriente eléctrica, que genera una reacción química que deposita el metal sobre la superficie.
En el caso del chapado en plata, la superficie metálica recibe una fina capa de plata. El proceso se realiza en cinco pasos: preparación de la superficie, limpieza con una solución química, aplicación de una corriente eléctrica a la superficie, deposición de la plata y finalmente, enfriamiento de la superficie.
El resultado final es una superficie con un aspecto brillante y de alta calidad. El chapado en plata se utiliza para mejorar la estética y la resistencia al desgaste, así como para aumentar la conductividad eléctrica. Además, esta técnica se utiliza para prevenir la corrosión en objetos metálicos.
Recubrimiento de cobre:
Recubrimiento de cobre: El recubrimiento de cobre se realiza mediante una técnica conocida como galvanoplastia. Esta técnica se utiliza para recubrir un metal con un metal más noble, como el cobre. Esto se logra mediante la aplicación de una corriente eléctrica a una solución de sulfato cúprico (CuSO4). Durante el proceso, el metal se oxida, lo que permite que el cobre se adhiera al metal. El proceso de galvanoplastia también se conoce como electrodeposición o electrolisis.
La galvanoplastia se utiliza para diversos fines, como para proteger el metal de corrosión, para aumentar la conductividad eléctrica, para reducir la fricción y para mejorar la apariencia del metal. El recubrimiento de cobre se puede aplicar a muchos metales y aleaciones, como el acero inoxidable, el aluminio, el hierro, el níquel y el bronce.
La galvanoplastia se realiza en un baño que contiene una solución acuosa de cobre. Un electrodo se conecta al metal que se va a recubrir, y el otro se conecta a la solución. Cuando se aplica una corriente eléctrica, el cobre se desprende de los electrodos y se deposita en el metal. El proceso se puede repetir varias veces para aumentar la densidad y la durabilidad del recubrimiento de cobre.
El recubrimiento de cobre se puede lograr también mediante la aplicación de una lámina de cobre sobre el metal. Esta técnica se conoce como laminado o laminación. El laminado se realiza con una máquina de laminado, que se utiliza para enrollar una lámina de cobre alrededor de una pieza de metal. El laminado se utiliza comúnmente para fabricar componentes para aplicaciones médicas, eléctricas y electrónicas.
La galvanoplastia y el laminado se utilizan para realizar un recubrimiento de cobre resistente y duradero. Estas técnicas se pueden combinar para lograr un recubrimiento de cobre de alta calidad. El recubrimiento de cobre mejora la conductividad eléctrica, reduce la fricción y protege el metal de la corrosión.
Diferencia entre electrólisis y galvanoplastia.
La Electrólisis y la Galvanoplastia son dos técnicas muy similares que se usan en la física para tratar materiales metálicos. Ambos procesos usan la electricidad para tratar un metal con una solución química, aunque cada uno de ellos tiene un propósito diferente.
La electrólisis se utiliza para separar átomos de una solución química, mientras que la galvanoplastia se usa para aplicar un revestimiento a un metal. En electrólisis, una corriente eléctrica se aplica a una solución que contiene los átomos que se desean separar. Esto hace que los átomos se muevan hacia los electrodos y sean separados de la solución.
En galvanoplastia, una corriente eléctrica se aplica a una solución que contiene un metal que se desea recubrir. El metal se deposita sobre la superficie del objeto siendo tratado, formando una capa de recubrimiento.
En la electrólisis, una corriente continua se aplica al metal. Esta corriente se usa para separar los átomos del metal, o para producir una reacción química que cambie la composición del metal.
En la galvanoplastia, sin embargo, se usa una corriente alterna para recubrir el metal con una capa de recubrimiento. Esta corriente se usa para hacer una reacción química, que deposita una capa del metal sobre la superficie del objeto.
Aunque ambos procesos usan la electricidad para tratar el metal, la diferencia principal entre la electrólisis y la galvanoplastia es el propósito. La electrólisis se usa para separar los átomos de una solución, mientras que la galvanoplastia se usa para aplicar un recubrimiento a un metal.
Electrólisis del agua
Electrólisis del agua es un proceso electroquímico en el que se aplica una corriente eléctrica para descomponer el agua en sus componentes, oxígeno y hidrógeno. Esta reacción se utiliza principalmente en la industria para la preparación de gases de alto grado de pureza, como el hidrógeno para usos industriales. También se utiliza en la producción de ácido clorhídrico, entre otras aplicaciones.
La electrólisis es un proceso físico por el cual una solución se descompone en sus elementos constituyentes mediante la aplicación de una corriente eléctrica. Esta corriente eléctrica provoca una reacción química que produce una descomposición de los materiales presentes en la solución. Esta descomposición puede ser muy útil para la producción de gases de alto grado de pureza.
La galvanoplastia es un proceso en el que una superficie metálica se recubre con una capa de metal para mejorar su resistencia a la corrosión, darle una mejor apariencia o para cambiar sus propiedades físicas. Esta técnica se utiliza principalmente en la fabricación de productos electrónicos, ya que ayuda a aumentar la durabilidad de los productos y mejora su funcionamiento.
La galvanoplastia se puede obtener mediante la aplicación de una corriente eléctrica a una solución que contenga una solución electrolítica. Esta solución es la misma que se usa para la electrólisis del agua, pero en lugar de descomponer el agua, se usa para recubrir la superficie metálica con una capa de metal. Esta capa de metal se aplica por medio de un proceso de deposición electroquímica en el que se aplica una corriente eléctrica para transferir el metal desde la solución a la superficie metálica.
¿Cuál es el principio detrás de la galvanoplastia?
La galvanoplastia es una técnica de recubrimiento de metal que se realiza mediante la aplicación de una corriente eléctrica. Esta técnica se aplica para recubrir una superficie con un metal como el cobre, el níquel, el cromo, el oro y la plata. El principio detrás de la galvanoplastia es la electrólisis.
Durante la electrólisis, una fuente de energía eléctrica es aplicada a dos electrodos inmersos en una solución electrolítica. El electrodo conectado a la fuente de energía positiva recibe cargas positivas (iones de cationes) de la solución electrolítica. Estas cargas positivas reaccionan con los átomos negativos (átomos de metal) en la superficie del electrodo, lo que resulta en la deposición de una fina capa de metal sobre la superficie.
La galvanoplastia se realiza con una configuración similar a la electrólisis, pero en lugar de aplicar una fuente de energía directamente a un electrodo, se conecta una fuente de energía a una superficie metálica, como una placa, que se llama una lámina de trabajo. Esta lámina de trabajo luego se sumerge en una solución electrolítica. La lámina de trabajo funciona como un electrodo negativo, mientras que el electrodo positivo se conecta a una fuente de energía.
La energía eléctrica generada por la fuente de alimentación se utiliza para transferir cargas positivas desde el electrodo positivo a la lámina de trabajo. Estas cargas positivas reaccionan con los átomos negativos de la superficie de la lámina de trabajo, lo que resulta en la deposición de una fina capa de metal sobre la superficie. La cantidad de metal depositado depende de la potencia suministrada a los electrodos y del tiempo que se sumerge la lámina de trabajo en la solución electrolítica.
La galvanoplastia es una técnica de recubrimiento de metal eficaz y se puede usar para aplicar una fina capa de metal a una amplia variedad de objetos, desde objetos cotidianos como clavos hasta objetos más complicados como máquinas herramientas. La galvanoplastia también se puede usar para recubrir superficies con diferentes tipos de metales, lo que le permite al usuario elegir el tipo de recubrimiento que más se ajuste a sus necesidades. Además, la galvanoplastia es un proceso relativamente rápido y barato, lo que la convierte en una técnica de recubrimiento de metal popular para una variedad de aplicaciones.
Mencione los propósitos de la galvanoplastia.
La galvanoplastia es un procedimiento electroquímico en el que se usa una corriente eléctrica para recubrir un metal con un recubrimiento de otro material. Esta técnica se utiliza para mejorar la resistencia al desgaste, la resistencia a la corrosión, la apariencia y otros propósitos. El proceso de galvanoplastia es una forma de electrólisis, una técnica en la que una corriente eléctrica se aplica a una solución para crear una reacción química. Esta reacción química puede producir un recubrimiento o una capa de otro material sobre el metal.
Los principales propósitos de la galvanoplastia incluyen:
1. Proteger el metal del desgaste y la corrosión: El recubrimiento de otro material se puede aplicar para mejorar la resistencia al desgaste y la corrosión de la superficie del metal. Esto puede ayudar a aumentar la vida útil del metal.
2. Aumentar la apariencia: El recubrimiento de materiales puede dar un aspecto más atractivo al metal. Esto puede ser útil para mejorar su apariencia en productos como joyas, herramientas, dispositivos eléctricos y otros.
3. Aumentar la conductividad eléctrica: La galvanoplastia también se puede usar para mejorar la conductividad eléctrica al aplicar un recubrimiento de un material conductor al metal.
4. Proporcionar una capa protectora: La galvanoplastia también se puede usar para proporcionar una capa protectora al metal para evitar la oxidación y la corrosión. Esto se logra al recubrir el metal con un recubrimiento que sea resistente a la corrosión.
5. Aumentar la durabilidad: El recubrimiento de materiales también se puede usar para mejorar la durabilidad del metal. Esto se logra al aplicar un recubrimiento resistente al desgaste.
Definir huelga de níquel.
Huelga de níquel es una técnica de galvanoplastia que se usa para recubrir objetos metálicos con un revestimiento de níquel. Esta técnica se aplica a diferentes materiales como el acero, aluminio, cobre y bronce para aumentar su resistencia a la corrosión y darles un acabado liso. La huelga de níquel se logra a través de la electrólisis, un proceso químico que se realiza al introducir un objeto en una solución de níquel y alimentarla con electricidad. Esta solución actúa como un catalizador, ayudando a la reacción química que recubre el objeto con níquel. Esta reacción química es el resultado de la oxidación del níquel, lo que ayuda a formar un revestimiento protector y durable en el objeto. Una vez que la galvanoplastia se ha completado, el objeto se remueve de la solución y se enjuaga para eliminar los restos de solución. Esto ayuda a asegurar que el objeto tenga un acabado liso y una resistencia a la corrosión adecuada.
La huelga de níquel se usa en una variedad de industrias para proteger objetos metálicos y mejorar su apariencia. Esta técnica se usa comúnmente en la industria automotriz, la industria de la joyería, la industria de la electrónica y la industria de la fabricación de herramientas. También se usa en la fabricación de joyas y elementos de decoración. La huelga de níquel es un método rentable y eficiente para aumentar la resistencia a la corrosión de objetos metálicos, así como para mejorar su apariencia.
¿Cuántos iones se pueden descargar durante la electrólisis?
La electrólisis y la galvanoplastica son procesos físicos que implican la separación de iones a partir del paso de una corriente eléctrica a través de un líquido. La electrólisis es un proceso en el que se forman por separado los iones positivos y negativos y se separan en la solución. La galvanoplastia, por otro lado, se refiere a un proceso en el que los iones positivos se adhieren a una superficie metálica para formar una capa protectora o un revestimiento. En ambos procesos, la cantidad de iones descargados depende de la cantidad de corriente eléctrica utilizada. Cuanto mayor sea la corriente eléctrica, mayor será la cantidad de iones descargados. Por lo tanto, no hay un límite para la cantidad de iones que se pueden descargar durante la electrólisis y la galvanoplastia.
Nombre el electrolito utilizado en las celdas de plomo-ácido.
Electrólisis: Es un proceso físico en el que una corriente eléctrica se aplica a un líquido que contiene iones para producir cambios químicos en los mismos. La electrólisis se utiliza frecuentemente en la galvanoplastia, un proceso en el que se deposita una capa fina de un metal sobre un objeto para aumentar su resistencia a la corrosión.
Celdas de plomo-ácido: Las celdas de plomo-ácido son un tipo de baterías recargables que contienen una solución de ácido sulfúrico como electrolito. Cuando la batería se descarga, el ácido sulfúrico se evapora, lo que provoca la formación de plomo en la parte superior de la celda. Al recargar la batería, el ácido sulfúrico se vuelve a formar en la parte inferior de la celda.
Electrolito utilizado en las celdas de plomo-ácido: El electrolito utilizado en las celdas de plomo-ácido es ácido sulfúrico. Esta solución está compuesta por iones de H+ y SO42- que se disuelven en agua. Estos iones se mueven a través de la batería cuando se aplica una corriente eléctrica, lo que permite que la batería se cargue y descargue.
Nombre el metal que se purifica mediante electrólisis.
Electrólisis es un proceso químico que se utiliza para separar los iones o moléculas de un compuesto disuelto en un líquido, al aplicar una corriente eléctrica. Esto se logra mediante la galvanoplastia, un proceso de recubrimiento de una superficie con un metal a partir de una solución de un compuesto del metal en un líquido conectado a una fuente de energía eléctrica. El metal que se purifica mediante esta técnica es el cobre. En la galvanoplastia, el cobre se deposita en una superficie metálica al pasar una corriente eléctrica a través de una solución de ácido sulfúrico y sal de cobre. Esta corriente eléctrica atrae a los iones de cobre hacia la superficie metálica, lo que resulta en un recubrimiento de cobre. El cobre recubierto se usa comúnmente para fabricar monedas.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.