En Física, la entalpía es una propiedad termodinámica que mide el calor contenido en un sistema en un estado dado. Está relacionada con la energía interna y con el trabajo realizado en el sistema. La entalpía, también conocida como contenido de calor específico, es una medida del calor que se libera o absorbe cuando un sistema pasa de un estado a otro. Puede ser considerada como una forma de energía potencial.
La entalpía se calcula a partir de la energía interna y el trabajo realizado por el sistema. La entalpía se define como la energía interna de un sistema más el trabajo realizado por el sistema. Por lo tanto, la entalpía se puede expresar como la suma de la energía interna y el trabajo realizado por el sistema.
La entalpía es una propiedad de los sistemas físicos. Esto significa que para un sistema dado, la entalpía es una cantidad constante. Esto significa que si se aumenta la energía interna del sistema, se libera calor al mismo tiempo. Esto se conoce como el principio de la entalpía.
La entalpía se mide en julios por mol (J/mol). Esto significa que se puede medir la cantidad de calor contenido en una molécula. Esto es útil para determinar la cantidad de energía que un sistema puede liberar o absorber.
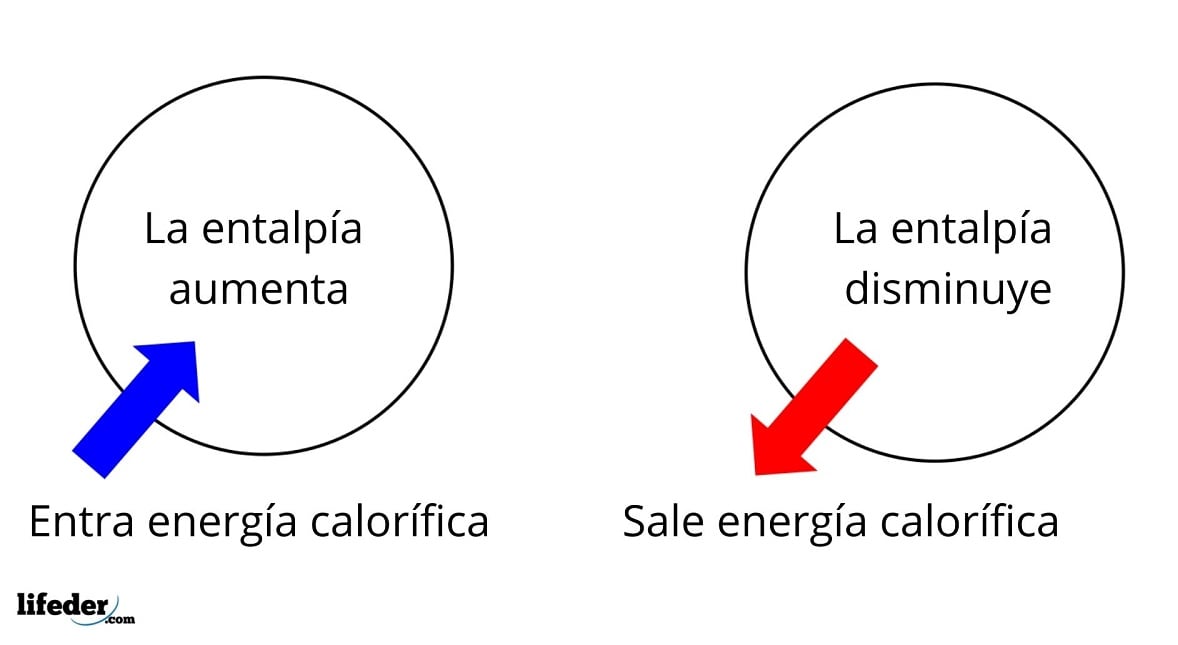
La entalpía se utiliza para medir el cambio de energía en un sistema. Si hay un cambio en la entalpía, se puede determinar si la energía se libera o se absorbe. Si hay una liberación de energía, se dice que hay una entalpía negativa. Si hay una absorción de energía, se dice que hay una entalpía positiva.
La entalpía se utiliza en muchas aplicaciones, como la ingeniería de procesos, la termodinámica, la química, la biología y la física. Se utiliza para calcular el calor necesario para cambiar un sistema de un estado a otro, así como para calcular la cantidad de energía que se libera o absorbe.
¿Qué es la entalpía?
Entalpía es una propiedad termodinámica que mide el contenido total de energía interna de un sistema. Esta energía proviene de dos fuentes: la energía cinética y la energía potencial. La entalpía se utiliza para describir los cambios de energía en un sistema cuando experimenta un proceso químico o físico. En la física, la entalpía también se conoce como el contenido de energía de un sistema.
La entalpía se representa con la letra griega H y se expresa como una cantidad de unidades de energía, como joules, kilojoules o calorías. La entalpía de un sistema se puede calcular como el cambio de energía en el sistema cuando se realiza un proceso. Por lo tanto, el cambio en la entalpía de un sistema depende de los procesos que experimenta el sistema, como cambios en la temperatura, presión o volumen.
Se puede usar la entalpía para medir el calor que se intercambia entre un sistema y su entorno. Cuando un sistema gana calor, la entalpía del sistema aumenta, mientras que cuando un sistema pierde calor, la entalpía del sistema disminuye. La entalpía también se usa para medir el trabajo realizado por o en un sistema. Por ejemplo, cuando un sistema realiza trabajo, la entalpía del sistema aumenta.
La entalpía es una propiedad termodinámica útil para describir un sistema en términos de energía. Esta propiedad se usa para realizar cálculos termodinámicos en los que se necesita conocer el contenido de energía de un sistema. También se usa para medir el calor y el trabajo que se intercambian entre un sistema y su entorno.
Unidades de entalpía
Unidades de entalpía es una medida de la energía contenida en una sustancia química. Esta energía es una parte importante de la termodinámica, y se expresa comúnmente en calorías o joules. La entalpía se puede medir en varias unidades diferentes, dependiendo del contexto. En Física, la entalpía se define como la energía interna de un sistema a temperatura constante. Esta energía es una función de estado que depende de la temperatura y presión. La entalpía se expresa comúnmente en joules (J) o en kilojoules (kJ). Sin embargo, algunas aplicaciones también requieren el uso de otras unidades como calorías (cal), British Thermal Units (BTU) o kilocalorías (kcal). La entalpía puede ser positiva o negativa, dependiendo de si la energía está siendo liberada o absorbida. Una entalpía positiva significa que la sustancia ha absorbido energía, mientras que una entalpía negativa significa que la sustancia ha liberado energía.
Prefijos SI:
Prefijos SI: Los prefijos son una parte integral del Sistema Internacional de Unidades (SI). Estos sirven para denotar múltiplos y submúltiplos de una unidad básica. Se utilizan para expresar cantidades o magnitudes de una manera más clara y fácil de comprender. Los prefijos SI se aplican principalmente a unidades de longitud, tiempo, masa, energía y temperatura.
El prefijo SI más comúnmente usado para medir la energía es el Joule (J). Un Joule es equivalente a 1 newton-metro (N · m) y se considera la cantidad de energía necesaria para realizar un trabajo de 1 Joule. En termodinámica, la entalpía se define como la cantidad de energía necesaria para realizar un proceso termodinámico, como el calentamiento de una sustancia. Por lo tanto, los prefijos SI se pueden aplicar a la entalpía para indicar la cantidad de energía involucrada. Por ejemplo, una entalpía de 1 kilojoule (kJ) equivale a 1000 Joules de energía.
¿Qué es la Termodinámica?
La Termodinámica es una rama de la física que estudia los efectos y procesos producidos por el intercambio de energía térmica. Esta disciplina también se puede definir como el estudio de la interacción entre la energía térmica y trabajo mecánico. La Termodinámica se ocupa de las leyes fundamentales que gobiernan la energía térmica y cómo ésta se transforma. Estas leyes se conocen como leyes de la Termodinámica.
Una de las nociones centrales de la Termodinámica es la entalpía. La entalpía es una propiedad interna de la materia representada por la energía térmica que se suma al trabajo mecánico. La entalpía se puede calcular como la suma de la energía térmica y la energía potencial. La entalpía se puede usar para calcular la cantidad de energía necesaria para llevar a cabo un proceso termodinámico. Esta cantidad de energía se conoce como entalpía de referencia o entalpía estándar. La entalpía se mide en julios.
¿Qué significa termodinámica?
.
La termodinámica es una rama de la física que estudia las relaciones entre la energía, la materia y el espacio. Está relacionada con la entropía, la energía interna, la entalpía, el calor y el trabajo. La entalpía es una magnitud física que estudia los cambios de energía de un sistema aislado durante un proceso. Está relacionada con la energía interna, el calor y el trabajo realizado sobre el sistema. La entalpía se mide en joules (J) y se representa con la letra H. La entalpía es una función de estado que mide los cambios de energía interna de un sistema durante un proceso, independientemente de la forma en que se realice el proceso. La entalpía se puede calcular a partir de la energía interna, el calor y el trabajo realizado sobre el sistema. La entalpía se puede calcular usando la Ecuación de Estado de Laplace: H = U + PV. Esta ecuación nos dice que la entalpía de un sistema es igual a su energía interna más el trabajo realizado sobre el sistema (PV). La entalpía se utiliza para medir los cambios de energía de un sistema durante un proceso, así como para predecir el comportamiento de los gases. La entalpía se utiliza en la energetica, la química, la termodinámica, la ingeniería química y otras disciplinas relacionadas.
¿Qué significa exactamente entalpía?
Entalpía es una propiedad termodinámica que mide la cantidad total de energía disponible en un sistema. Está relacionada con la energía interna, la entropía y la energía libre. La entalpía se representa como H y se mide en julios (J).
En física, la entalpía es la energía total de un sistema, incluyendo la energía interna y la energía de interacción externa. Esto incluye la energía potencial cinética, el calor cambiado entre el sistema y el entorno, y la energía asociada con las reacciones químicas que ocurren dentro del sistema. La entalpía se puede cambiar mediante un cambio de temperatura, presión o composición química.
La entalpía es una propiedad termodinámica importante para entender cómo los sistemas cambian bajo ciertas condiciones. Por lo tanto, es útil para predecir el comportamiento de los sistemas, como los ciclos de calor y las reacciones químicas.
¿Qué es exactamente la primera ley de la termodinámica?
La primera ley de la termodinámica es una ley fundamental de la física que establece que la energía de un sistema aislado se conserva. Esta ley se conoce como la ley de la conservación de la energía. Esta ley afirma que la energía puede ser transformada de una forma a otra, pero nunca se destruye ni se crea. Esta ley se aplica a muchos aspectos de la física, desde el movimiento de los planetas hasta el comportamiento de los gases.
En cuanto a la entalpía, esta es una propiedad termodinámica que mide la energía interna de un sistema en un estado dado. Esta energía es la suma de la energía cinética y la energía potencial de los componentes del sistema. También se conoce como contenido interno de energía, y se usa para estudiar los cambios de estado de un sistema. La entalpía se usa para calcular el trabajo potencial en un proceso termodinámico. La primera ley de la termodinámica se relaciona directamente con la entalpía, ya que establece que la variación de entalpía de un sistema cerrado es igual a la energía transferida por calor al sistema.
¿Qué es exactamente la segunda ley de la termodinámica?
La segunda ley de la termodinámica es una ley básica de la termodinámica que establece que la energía total de un sistema, incluyendo energía calorífica, no puede ser destruida, sino que siempre se conserva en su totalidad. Esta ley, también conocida como la ley de conservación de la energía, es la base de la teoría científica moderna y se refiere a la transferencia de energía entre los componentes de un sistema. La segunda ley de la termodinámica también establece que el proceso natural de un sistema es hacia un estado de desequilibrio y caos, es decir, un estado de energía dispersa.
En relación con la entalpía, la segunda ley de la termodinámica establece que la entalpía de un sistema cerrado que no experimenta reacciones químicas, por lo tanto, no puede disminuir. Esto significa que el calor liberado por un sistema en proceso de enfriamiento no puede ser utilizado de forma útil para realizar un trabajo. Si bien el calor liberado puede ser utilizado para aumentar la temperatura de un cuerpo, el trabajo realizado en el proceso no se puede recuperar. Por lo tanto, el calor liberado en un sistema está en un estado de desequilibrio y no puede ser utilizado para realizar trabajo útil.
¿Qué es la tercera ley de la termodinámica?
La Tercera Ley de la Termodinámica es una ley que se refiere a la entropía de un sistema a temperatura absoluta cero. Esta ley dice que la entropía de un sistema a temperatura cero es un número finito y constante. Esta ley es importante porque explica por qué los procesos espontáneos se dirigen hacia estados con entropía más alta.
En relación a la entalpía, la Tercera Ley de la Termodinámica implica que la entalpía de un sistema a temperatura cero es igual a su contenido de energía interna. Esto significa que la entalpía de un sistema a temperatura cero no puede cambiar a menos que la energía interna cambie. Esto explica por qué la entalpía de un sistema a temperatura cero es una propiedad constante. Esto también significa que un sistema a temperatura cero no puede experimentar una reacción química, ya que no hay energía para mover los reactivos a productos.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.