Espectro Átomo es el estudio de la luz emitida de los átomos. Esta luz emitida se llama luz de emisión, y se compone de un patrón característico de líneas de longitud de onda específicas. Estas líneas se conocen como el espectro átomo.
En física, el espectro átomo es una herramienta útil para el estudio de la estructura de los átomos. El patrón de líneas de longitud de onda del espectro átomo se puede usar para identificar los elementos químicos presentes en una muestra. El patrón de líneas de longitud de onda también se puede usar para determinar la energía de los niveles de energía de los electrones en los átomos.
Cuando un átomo está excitado, es decir, que tiene energía en exceso, los electrones se mueven a niveles de energía más altos. Esto se conoce como un salto cuántico. Cuando esto ocurre, el átomo emite luz de una longitud de onda específica. Esta longitud de onda específica es el patrón de líneas del espectro átomo.
Los átomos emiten luz de varias longitudes de onda diferentes debido a sus niveles de energía diferentes. Esto significa que el espectro átomo de cada elemento químico es único. Esto significa que el espectro átomo se puede usar para identificar los elementos químicos presentes en una muestra. Esta es una técnica conocida como espectroscopía átomo.
¿Qué son los espectros atómicos?
Los espectros atómicos son la representación gráfica de los patrones de luz emitidos por los elementos cuando se les somete a un campo electromagnético. Esta representación se conoce como «espectro atómico» y es una de las principales herramientas de los químicos para identificar los elementos químicos. Estos patrones de luz se producen cuando los electrones de un átomo se excitan al absorber energía. Cuando los electrones regresan a sus niveles de energía más bajos, emiten luz con un patrón único. Esta luz se puede medir para determinar qué elementos están presentes en una muestra.
Los espectros atómicos se dividen en dos categorías principales: espectro de emisión y espectro de absorción. El espectro de emisión se produce cuando un átomo absorbe energía y luego la emite en forma de luz. El espectro de absorción se produce cuando un átomo absorbe energía de la luz ambiente y luego la emite en un patrón único. Estos espectros son únicos para cada elemento y pueden ser usados para identificar a los elementos químicos.
Los espectros atómicos se pueden usar para medir los niveles de energía de los electrones en un átomo. Esto se conoce como «niveles de energía atómicos». Estos niveles de energía se pueden usar para determinar la configuración electrónica de los átomos. Esta configuración electrónica se usa para determinar las propiedades físicas y químicas de los átomos. Los espectros atómicos también son útiles para identificar los elementos químicos en una muestra.
Los espectros atómicos son herramientas esenciales para los químicos y estudiantes de física. Estos patrones de luz ayudan a entender la estructura y los niveles de energía de los átomos. Esto permite a los científicos realizar experimentos y descubrir nuevos elementos químicos. Estos espectros también se usan para identificar los elementos químicos en una muestra.
Serie espectral del átomo de hidrógeno
Serie espectral del átomo de hidrógeno: Se trata de una serie de líneas de emisión que se observan en el espectro atomico del hidrógeno. Estas líneas corresponden a determinadas energías con las que los electrones del átomo de hidrógeno pasan de un nivel de energía a otro.
Esta serie espectral es una de las más importantes para la física atómica ya que fue el primer sistema atomico en el que se pudo observar directamente el paso de los electrones entre los niveles de energía. Esto fue posible gracias al descubrimiento de la luz emitida por un gas de hidrógeno sometido a descargas eléctricas, descubierto por el físico alemán Johann Balmer en 1885.
La serie espectral del átomo de hidrógeno consiste en cuatro líneas principales: serie Balmer, serie Paschen, serie Brackett y serie Pfund. Estas líneas se originan cuando los electrones del átomo de hidrógeno saltan desde los niveles iniciales hasta niveles de energía superiores.
Cada una de estas líneas de la serie espectral del átomo de hidrógeno tiene una energía característica que depende de los niveles entre los cuales se producen los saltos. Esta energía se mide en unidades de longitud de onda, como nanómetros (nm). La línea más baja de la serie Balmer es la línea H-alpha, con una longitud de onda de 656 nanómetros.
Además de estas líneas principales, hay otras líneas que se observan en el espectro del átomo de hidrógeno, como la serie Lyman, que se origina cuando los electrones saltan desde niveles energéticos iniciales a los niveles más bajos. Estas líneas se encuentran en la parte ultravioleta del espectro.
En conclusión, la serie espectral del átomo de hidrógeno es una de las más importantes en la física atómica. Está compuesta por cuatro líneas principales y una serie de líneas secundarias, que se producen cuando los electrones del átomo de hidrógeno saltan entre distintos niveles de energía. Estas líneas se observan en el espectro atomico y se miden en unidades de longitud de onda.
Fórmula Rydberg
Fórmula Rydberg: es una fórmula matemática que describe el comportamiento de los niveles de energía de los átomos. Fue descubierta por el físico sueco Johannes Rydberg en 1888. Esta fórmula es aplicada para predecir el espectro de emisión de los átomos. Esta fórmula describe la energía de los niveles de energía de los electrones en los átomos. Esta fórmula se basa en los principios de la mecánica cuántica. Según la fórmula, la energía de un nivel de energía de un electrón de un átomo depende de la masa del electrón y de la constante de Rydberg (Rh).
La fórmula Rydberg se utiliza para predecir el espectro atómico, que es el conjunto de líneas espectrales características emitidas por un átomo. Estas líneas espectrales están relacionadas con los niveles de energía de los electrones en los átomos. Cuando los electrones pasan de un nivel de energía a otro, emiten luz con una longitud de onda característica. Esta longitud de onda depende del salto de energía entre los dos niveles de energía. La fórmula Rydberg se utiliza para predecir la longitud de onda de estas líneas espectrales. Esto permite a los científicos estudiar los átomos y los materiales a partir del espectro atómico.
Espectroscopía atómica
Espectroscopía atómica es una forma de espectroscopía de luz que se utiliza para estudiar la estructura, composición y movimiento de los átomos. Utilizando luz con diferentes longitudes de onda, los científicos pueden medir el espectro atómico, el patrón de líneas que se forman cuando los átomos emiten o absorben luz. Esta información se puede utilizar para identificar qué elementos están presentes en una muestra y para determinar su concentración.
Los espectros atómicos se producen cuando los electrones de un átomo se mueven de un nivel de energía a otro. Esto ocurre cuando los electrones absorben o emiten luz con una longitud de onda específica. Esto se conoce como líneas espectrales y cada elemento tiene su propio patrón de líneas espectrales.
La espectroscopía atómica se puede utilizar para estudiar el movimiento de los átomos en un cuerpo. Esto se logra mediante el uso de un láser para excitar los átomos de la muestra. Esta excitación produce un espectro de luz único que se puede usar para medir la velocidad de los átomos y la temperatura del cuerpo.
Los espectros atómicos también se pueden usar para determinar la estructura de los átomos. Esto se logra mediante el uso de una técnica conocida como espectroscopía de resonancia magnética nuclear. Esta técnica se basa en el hecho de que los núcleos de los átomos se comportan como pequeños imanes que pueden absorber luz de longitud de onda específica. Esta información se puede utilizar para determinar la estructura de los átomos.
La espectroscopía atómica es una herramienta útil para los científicos que están estudiando la estructura, composición y movimiento de los átomos. Esta técnica se ha utilizado para estudiar los átomos en la Tierra, el Universo y en los laboratorios. La espectroscopía atómica es una herramienta importante para comprender mejor el Universo y la naturaleza de la materia.
Usos de la espectroscopia atómica
Espectroscopia Atómica es una técnica de análisis que se utiliza para identificar el contenido químico de una muestra. Esta técnica se basa en la emisión y absorción de energía de los átomos. La Espectroscopia Atómica está relacionada con la Física Atómica, ya que se estudia el comportamiento de los átomos cuando son expuestos a una fuente de luz. La luz se usa para excitar los átomos, lo que causa que los electrones se muevan a estados de energía más altos. Cuando los electrones regresan a sus estados de energía originales, emiten energía en forma de luz, que es recogida por el espectrómetro. La luz emitida se mide en función de su longitud de onda y se utiliza para identificar los elementos presentes en la muestra. La Espectroscopia Atómica se puede utilizar para medir la concentración de los elementos en una muestra, y también se utiliza para realizar análisis de compuestos orgánicos. Esta técnica es útil para la identificación de impurezas en una muestra.
¿Qué son los espectros atómicos?
Los Espectros Atómicos son una herramienta útil para estudiar los átomos de una sustancia. Estos espectros se generan cuando un átomo se expone a una fuente de radiación electromagnética, como un láser. Cuando esto sucede, el átomo absorbe la energía de la radiación y la emite en forma de líneas espectrales. Estas líneas espectrales son características de los átomos y se pueden usar para identificar los elementos químicos presentes. Esto se conoce como la Teoría del Espectro Atómico.
La Teoría del Espectro Atómico se basa en las teorías de Max Planck, Albert Einstein y Niels Bohr. Estos científicos descubrieron que los átomos se comportan de manera diferente cuando se les expone a la luz. Esto se debe a que los átomos tienen diferentes niveles de energía, que se conocen como niveles cuánticos. Los átomos absorbirán la luz cuando la energía de la luz sea igual a la diferencia entre los niveles cuánticos. Esto significa que los átomos emitirán luz de diferentes longitudes de onda cuando se les expone a la luz. Estas longitudes de onda producen líneas espectrales características.
La Teoría del Espectro Atómico también se usa para estudiar los elementos químicos que componen una estrella. Esto se conoce como Espectroscopía Estelar. La luz de una estrella se puede descomponer en sus líneas espectrales, lo que permite determinar qué elementos químicos están presentes en la estrella. Esta información es útil para entender mejor el origen, la edad y la evolución de la estrella.
En conclusión, los espectros atómicos son una herramienta útil para estudiar los átomos de una sustancia. Esta información se puede usar para identificar los elementos químicos presentes en una sustancia y para entender mejor el origen, la edad y la evolución de una estrella.
¿Cuáles son los tipos de espectros atómicos?
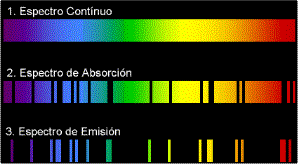
Espectro Atómico es una herramienta de medición de la estructura de los átomos, que se usa para identificar los elementos químicos. Está compuesto por líneas espectrales, que son emisiones de luz cuyas longitudes de onda se encuentran asociadas a los niveles de energía de los electrones de los átomos. Los espectros atómicos se clasifican en tres tipos principales: Espectros de Emisión, Espectros de Absorción y Espectros de Fluorescencia.
Espectro de Emisión: es el más conocido y se produce cuando los electrones de un átomo se excitan al absorber energía y después dejan de emitir un patrón de líneas espectrales cuando vuelven a su estado fundamental.
Espectro de Absorción: se produce cuando una luz blanca incidente se ve afectada por una sustancia en forma de gas atómico. La luz incidente se ve atenuada, de manera que sólo se observan las líneas espectrales características de los átomos del gas.
Espectro de Fluorescencia: se produce cuando una sustancia se excita con luz ultravioleta y, como resultado, emite luz visible. Esta luz visible, emitida por los átomos excitados, tiene un patrón espectral característico.
Indique verdadero o falso: la espectroscopia atómica se utiliza para identificar las líneas espectrales de los materiales utilizados en la metalurgiaEl estudio de la radiación electromagnética absorbida o emitida por los átomos se conoce como?
Verdadero: La espectroscopia atómica se utiliza para identificar las líneas espectrales de los materiales utilizados en la metalurgia. El estudio de la radiación electromagnética absorbida o emitida por los átomos se conoce como Espectro Atómico. La espectroscopia atómica se utiliza para la identificación de los elementos químicos, ya que cada elemento tiene un patrón de líneas espectrales único. Estos patrones se utilizan para construir la tabla periódica de los elementos. La espectroscopia atómica también se utiliza en la metalurgia para identificar los elementos presentes en los materiales, como el acero. Esto se logra mediante la medición de la intensidad de las líneas espectrales emitidas por los elementos. Esto ayuda a determinar su composición química, lo que es útil para controlar la calidad de los productos metalúrgicos.
¿Cuáles son los tipos de espectroscopia atómica?
Espectroscopia Atómica es una técnica de análisis químico que se utiliza para identificar los elementos presentes en una muestra. Esta técnica se basa en la medición de la radiación emitida por átomos al ser excitados por energía, que se conoce como espectro atómico. Los diferentes tipos de espectroscopia atómica se utilizan para analizar diferentes características de los átomos, como su energía, masa y estructura electrónica.
Los tipos más comunes de espectroscopia atómica son los siguientes:
Espectroscopia de Emisión Atómica: Esta técnica se basa en el principio de que cuando los átomos se excitan con energía, emiten luz visible de diferentes longitudes de onda. Esta luz se puede medir para determinar la identidad de los átomos presentes en la muestra.
Espectroscopia de Absorción Atómica: Esta técnica se basa en el principio de que los átomos absorben luz de diferentes longitudes de onda cuando se les expone a la luz. Esta luz absorbida se puede medir para determinar la concentración de los átomos presentes en la muestra.
Espectroscopia de Fluorescencia Atómica: Esta técnica se basa en el principio de que cuando los átomos absorben luz, emiten luz de diferentes longitudes de onda. Esta luz emitida se puede medir para determinar la energía y la estructura electrónica de los átomos presentes en la muestra.
Espectroscopia de Excitación Selectiva Atómica: Esta técnica se basa en el principio de que los átomos absorben luz de diferentes longitudes de onda cuando se les expone a luz de alta energía. Esta luz absorbida se puede medir para determinar la masa de los átomos presentes en la muestra.
Espectroscopia de Rayos X Atómica: Esta técnica se basa en el principio de que los átomos emiten rayos X cuando se excitan con energía. Estos rayos X emitidos se pueden medir para determinar la estructura electrónica de los átomos presentes en la muestra.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.