Radios Atómicos son una propiedad física de los átomos que se refiere a la distancia promedio entre el núcleo y los electrones. Ésta es una de las principales mediciones de los átomos y se mide en unidades de Ångström (Å). Los radios atómicos se utilizan para determinar la estabilidad de un elemento químico y también para predecir sus propiedades químicas.
Los radios atómicos se clasifican en tres categorías principales: radios atómicos de covalencia, radios atómicos de van der Waals y radios atómicos de ionización. El radio atómico de covalencia se refiere a la distancia entre los átomos en una molécula que están unidos por enlaces covalentes, mientras que el radio atómico de van der Waals se refiere a la distancia entre los átomos en una molécula que están unidos por enlaces de fuerzas de van der Waals. El radio atómico de ionización se refiere a la distancia entre el núcleo y los electrones en un átomo, que es una medida de la estabilidad del átomo.
Los radios atómicos son una característica importante para la química y la física de los átomos. Esta propiedad determina la fuerza de los enlaces entre átomos, los límites de la estructura cristalina, así como las propiedades químicas de los átomos. También se utilizan para predecir la formación de compuestos y la reactividad química. Los radios atómicos también son importantes para la teoría de la química cuántica, ya que se utilizan para predecir la energía de átomos y moléculas.
¿Qué son los radios atómicos o radio atómico?
Los radios atómicos o radio atómico son la medida de la distancia entre el núcleo atómico y la capa más externa de electrones de un átomo. Esta medida se expresa generalmente en nanómetros (nm) o en picómetros (pm). El radio atómico se determina mediante experimentos de dispersión de electrones o de rayos X, y es una de las características más importantes para determinar las propiedades físicas y químicas de los átomos. La magnitud del radio atómico varía significativamente entre los elementos de la tabla periódica. Por ejemplo, el radio atómico del oxígeno es de 0,066 nm, mientras que el del sodio es de 0,184 nm.
El radio atómico también se puede usar para clasificar a los átomos de un elemento en varios grupos. Los átomos de un mismo elemento que tienen el mismo número de electrones pero diferentes niveles de energía se conocen como isótopos. Los isótopos tienen radios atómicos ligeramente diferentes. Por ejemplo, el isótopo más común del oxígeno, el oxígeno-16, tiene un radio atómico de 0,066 nm, mientras que el isótopo más pesado, el oxígeno-18, tiene un radio atómico de 0,071 nm. Esto significa que el oxígeno-18 es un poco más grande que el oxígeno-16.
Además, el radio atómico también se usa para determinar la estructura cristalina de los materiales. Los átomos se agrupan en diversas formas y tamaños según su radio atómico. Por ejemplo, los metales tienen una estructura cristalina en la que los átomos se encuentran cerca unos de otros. Esto se debe a que los metales tienen un radio atómico relativamente pequeño. Por el contrario, los materiales no metálicos tienen una estructura cristalina en la que los átomos están más separados entre sí. Esto se debe a que los materiales no metálicos tienen un radio atómico relativamente grande.
Tipos de radio atómico con respecto a los tipos de enlace
Los radios atómicos son la distancia entre el núcleo atómico y la última capa orbital. Esta distancia varía dependiendo del elemento químico, por lo que existen diferentes tipos de radios atómicos. Estos radios atómicos están relacionados con los distintos tipos de enlaces químicos que se forman entre los átomos.
Los tipos de radios atómicos que existen están clasificados en tres categorías principales: radios covalentes, radios iónicos y radios metálicos. Los radios covalentes son los radios atómicos de los átomos que se unen mediante enlaces covalentes, que son los enlaces entre átomos de igual electronegatividad. Estos enlaces son extremadamente fuertes y los radios covalentes son relativamente pequeños.
Los radios iónicos son los radios atómicos de los átomos que se unen mediante enlaces iónicos, que son los enlaces entre átomos con diferentes electronegatividades. Estos enlaces son extremadamente fuertes y los radios iónicos son generalmente mayores que los radios covalentes.
Los radios metálicos son los radios atómicos de los átomos que se unen mediante enlaces metálicos, que son enlaces entre átomos con diferentes electronegatividades. Estos enlaces son muy fuertes y los radios metálicos son generalmente mayores que los radios covalentes o iónicos.
En conclusión, los tipos de radios atómicos están relacionados con los diferentes tipos de enlaces químicos que se forman entre los átomos. Los radios covalentes son los más pequeños, mientras que los radios iónicos y metálicos son mayores.
Radio covalente
Radio covalente: Se trata de una medición de la distancia entre los núcleos de los átomos de una molécula. Es igual a la mitad de la longitud de enlace covalente entre dos átomos de una molécula. Esta medición se expresa en Ångström (Å). Se utiliza para determinar la forma y la estructura de una molécula.
Relación con radios atómicos: El radio covalente se relaciona directamente con los radios atómicos de los átomos involucrados. Esto se debe a que para que dos átomos se unan mediante un enlace covalente, deben estar lo suficientemente cerca para que los orbitales de los electrones de cada átomo se solapen. El radio covalente es la distancia a la que los orbitales de los electrones se solapan para formar el enlace covalente.
Radio iónico
El radio iónico es una magnitud física que se refiere al radio de un átomo o ión, es decir, la distancia que separa el núcleo atómico de la última capa de electrones. Esta magnitud se representa con la letra R, y se mide en Ångström (Å).
El radio iónico se relaciona directamente con los radios atómicos. Este último es el radio de un átomo neutro, es decir, un átomo que no ha sufrido ninguna reacción química. En la tabla periódica, el radio atómico va aumentando a medida que se transita de uno a otro grupo, es decir, de izquierda a derecha.
En cambio, el radio iónico se refiere al radio de un átomo o ión, y presenta variaciones dependiendo de la naturaleza del átomo o ión. Por ejemplo, en un átomo o ión monovalente, la capa de electrones es más pequeña que en un átomo o ión covalente, por lo que su radio iónico es menor.
Por otro lado, el radio iónico es una de las magnitudes más importantes que se estudian en química y física, ya que permite determinar la configuración electrónica de los átomos y los iones, así como los enlaces que se establecen entre estos. Esta información es esencial para comprender la estructura y propiedades químicas de un compuesto.
En conclusión, el radio iónico se relaciona directamente con los radios atómicos y se utiliza para determinar la configuración electrónica de los átomos y los iones.
Radio Metálico
Radio Metálico es un concepto relacionado con la física de los radios atómicos. Se refiere a la cantidad de energía emitida por un átomo. Esta energía es liberada cuando un átomo se desintegra, lo que provoca su transmutación en un átomo con menos masa. Este proceso se conoce como desintegración radiactiva.
Los radios metálicos se clasifican en radios alfa, beta y gamma. Los radios alfa se emiten cuando un átomo se desintegra y libera dos partículas alfa. Estas partículas son positivamente cargadas y se mueven a altas velocidades. Los radios beta se emiten cuando un átomo se desintegra y libera una partícula beta. Esta partícula es negativamente cargada y se mueve a velocidades intermedias. Por último, los radios gamma se emiten cuando un átomo se desintegra y libera una onda electromagnética. Esta onda es una forma de radiación electromagnética de alta energía.
Los radios metálicos son una forma de energía muy poderosa y están presentes en muchos materiales. Se encuentran en la naturaleza, así como en los residuos nucleares. Además, se usan en la medicina, la industria, la agricultura y la investigación científica. Los radios metálicos se usan para detectar fallas en equipos eléctricos, para identificar materiales, para diagnosticar enfermedades y para curar ciertas enfermedades.
Aunque los radios metálicos son útiles, también pueden ser peligrosos si son expuestos a niveles altos de radiación. La exposición a niveles altos de radiación puede afectar la salud y el bienestar humano. Por lo tanto, es importante tomar precauciones para evitar la exposición a los radios metálicos.
Otros términos relacionados con el radio atómico
Radios atómicos: es una medida de la distancia entre el núcleo atómico y los electrones en órbita. Es una cantidad importante para la predicción de la estructura de los átomos y moléculas. El radio atómico se mide en ångströms, que es una unidad de longitud equivalente a 10-10 metros.
Radio nuclear: es la medida de la distancia entre el núcleo atómico y los neutrones en órbita. Esta cantidad también es importante para predecir la estructura de los átomos y moléculas. El radio nuclear se mide en fermis, que es una unidad de longitud equivalente a 10-15 metros.
Radio de Van der Waals: es una medida de la distancia promedio entre los átomos o moléculas vecinas, debido a los efectos de la interacción electrostática entre ellos. El radio de Van der Waals se mide en ångströms, que es una unidad de longitud equivalente a 10-10 metros.
Radio covalente: es la medida de la distancia promedio entre los átomos o moléculas vecinas, debido a la unión covalente entre ellos. El radio covalente se mide en ångströms, que es una unidad de longitud equivalente a 10-10 metros.
Radio iónico: es la medida de la distancia promedio entre los átomos o iones vecinos, debido a la unión iónica entre ellos. El radio iónico se mide en ångströms, que es una unidad de longitud equivalente a 10-10 metros.
Radio de Van Der Waals
Radio de Van Der Waals es un concepto usado en física para describir la distancia promedio entre dos átomos o moléculas que están unidos por una fuerza de Van der Waals. Esta fuerza es una fuerza débil de atracción entre átomos o moléculas, y el radio de Van der Waals es la distancia a la que la fuerza se vuelve significativa. Esta distancia es significativamente mayor que el radio atómico de los átomos o moléculas individuales y es una representación aproximada de la distancia entre ellos. La relación entre los radios de Van der Waals y los radios atómicos se conoce como el factor de aumento del radio, que es una cantidad que varía según el tipo de átomo o molécula.
El radio de Van der Waals es un concepto clave en la química orgánica para determinar la reactividad de los compuestos. Esto se debe a que el radio de Van der Waals determina la distancia a la que las moléculas se pueden acercar antes de sentir la fuerza de atracción entre ellas. Esta fuerza es una fuerza de atracción de corto alcance que es mucho más débil que la fuerza de enlace covalente que se encuentra en los compuestos químicos. Esta fuerza de atracción puede ser suficiente para permitir que los compuestos se organicen en estructuras complejas, como las encontradas en la vida diaria.
Radio de Bohr
Radio de Bohr es un concepto importante en física relacionado directamente con los radios atómicos. Se trata de la distancia entre el núcleo de un átomo y su electrón más externo. Fue propuesto por el físico danés Niels Bohr en 1913, como parte de su modelo atómico. El radio de Bohr se calcula en términos de la constante de Planck, la masa de un electrón y la carga eléctrica del átomo.
La constante de Planck define la relación entre la energía y la frecuencia de una onda electromagnética. La masa de un electrón es la unidad básica de masa en el Sistema Internacional de Unidades. La carga eléctrica de un átomo se mide en Coulombs. El radio de Bohr se expresa en metros.
El radio de Bohr se utiliza para calcular la distancia a la que se encuentran los electrones más externos de un átomo, lo que permite predecir la estabilidad de un átomo. Se ha encontrado que el radio atómico aumenta a medida que aumenta el número atómico. Esto significa que los átomos más grandes tienen electrones más alejados del núcleo. Esto explica la tendencia general de los átomos a ganar electrones para formar enlaces químicos y formar compuestos.
El radio de Bohr también se utiliza para calcular la energía de los estados cuánticos de los electrones. Esto significa que la energía de los electrones depende de la distancia entre ellos y el núcleo. Esto explica por qué los átomos estables tienen el mismo número de electrones en los niveles de energía más bajos.
Tendencias periódicas de los radios atómicos
Tendencias Periódicas de los Radios Atómicos es un término usado en química para describir la forma en que los radios atómicos varían con la ubicación de un elemento en la tabla periódica. Los radios atómicos son la medida de la distancia entre el núcleo de un átomo y sus electrones más externos. Esta tendencia es importante para comprender la estructura de los materiales y la interacción entre los átomos.
En física, el radio atómico es una medida de la extensión de la distribución electrónica alrededor del núcleo del átomo y es una de las principales propiedades de los átomos. El radio atómico de un átomo está relacionado con la cantidad de electrones que componen su capa exterior. Cuanto mayor sea el número de electrones en la capa exterior, mayor será el radio atómico.
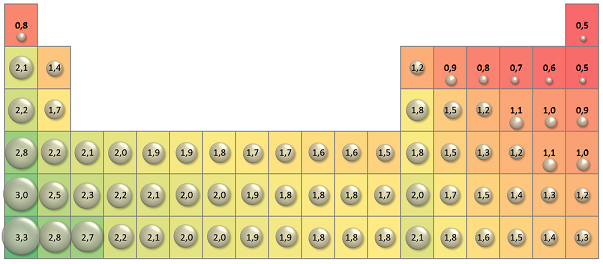
Los radios atómicos de los elementos varían a lo largo de la tabla periódica. Esto se debe a los diferentes números de electrones en la capa exterior de los átomos de cada elemento. Por ejemplo, los elementos de la primera columna tienen el radio atómico más pequeño, mientras que los elementos de la última columna tienen el radio atómico más grande. Esto se debe a que los elementos de la primera columna tienen un electrón en su capa exterior, mientras que los elementos de la última columna tienen ocho electrones en su capa exterior.
Además, a medida que se avanza hacia la derecha en la tabla periódica, los radios atómicos se hacen más grandes. Esto se debe a que los elementos tienen un número creciente de capas electrónicas, lo que resulta en un radio atómico más grande. Por el contrario, a medida que se avanza hacia la izquierda en la tabla, los radios atómicos se hacen más pequeños debido a que hay un número decreciente de capas electrónicas.
Otra tendencia periódica en los radios atómicos es que los elementos de los grupos familiares tienen radios atómicos similares. Esto es así porque los elementos de un grupo familiar tienen una misma cantidad de electrones en su capa exterior. Esto significa que los elementos de un grupo familiar tendrán radios atómicos similares.
En resumen, las tendencias periódicas de los radios atómicos describen la forma en que los radios atómicos varían con la ubicación de un elemento en la tabla periódica. El radio atómico generalmente disminuye a medida que se avanza hacia la izquierda de la tabla periódica debido a que hay un número decreciente de capas electrónicas, y generalmente aumenta a medida que se avanza hacia la derecha debido a que hay un número creciente de capas electrónicas. Además, los elementos de los grupos familiares tienen radios atómicos similares debido a que tienen una misma cantidad de electrones en su capa exterior.
¿Aumenta el radio atómico a lo largo de un período?
Un radio atómico es la distancia entre el núcleo de un átomo y sus electrones. Esta medida se expresa en ångströms (Å), con 1 Å = 10-10 m. El radio atómico varía dependiendo del elemento químico y su configuración electrónica.
En un período de la tabla periódica, los elementos tienen la misma configuración electrónica. Esto significa que los elementos en el mismo período tienen radios atómicos similares. Sin embargo, a medida que se mueve a lo largo del período, el radio atómico de los elementos aumenta. Esto se debe a que los elementos en el extremo izquierdo del período tienen una carga nuclear más grande, lo que permite a los electrones estar más lejos. Por lo tanto, el radio atómico aumenta a medida que se mueve a lo largo del período.
Además, los elementos en la parte superior de un grupo tienen un radio atómico más grande que los elementos en la parte inferior de un grupo. Esto se debe a que los elementos en la parte superior de un grupo tienen un número de electrones de valencia mayor, lo que aumenta la distancia entre el núcleo y los electrones.
En conclusión, el radio atómico generalmente aumenta a lo largo de un período. Esto se debe a la mayor carga nuclear en los elementos de un lado de un período y al mayor número de electrones de valencia en los elementos de un grupo.
¿Por qué no se pueden medir directamente los radios atómicos?
.
Los radios atómicos son una medida que se utiliza para describir el tamaño atómico de un elemento químico. Esta medida se obtiene midiendo el diámetro medio de un átomo de un elemento dado. Los radios atómicos se miden en ångström (Å).
Sin embargo, los radios atómicos no se pueden medir directamente. Esto se debe a que los átomos son demasiado pequeños para ser medidos directamente. En su lugar, los científicos usan una variedad de métodos para estimar el tamaño de los átomos. Uno de los métodos más comunes es el método de distancia de enlace covalente, que se basa en la distancia entre átomos en un enlace covalente. También se usan métodos basados en la teoría de la estructura electrónica de los átomos.
Los radios atómicos son una característica importante de los átomos, ya que determinan la química de un elemento. Por ejemplo, los átomos con radios atómicos más grandes suelen tener una mayor tendencia a formar enlaces covalentes, mientras que los átomos con radios atómicos más pequeños tienen una mayor tendencia a formar enlaces iónicos. Además, los radios atómicos también influyen en la solubilidad de un compuesto. Por ejemplo, los compuestos con átomos de radios atómicos grandes suelen ser menos solubles en agua que los compuestos con átomos de radios atómicos pequeños.
¿Cuál es el significado de los radios atómicos?
Los radios atómicos son una medida de la distancia desde el núcleo de un átomo hasta la última capa de electrones. Esta medida es importante para entender la estructura de los átomos, ya que determina la cantidad de energía que los electrones tendrán, y por lo tanto, la forma en que los átomos se comportarán en una reacción química. El radio atómico también puede ser usado para predecir la estabilidad de los átomos, ya que los átomos más grandes son más estables que los átomos más pequeños. Los radios atómicos varían entre los elementos, dependiendo del número de protones en el núcleo.
En física, los radios atómicos se usan para calcular la energía de enlace entre los átomos, y la energía de enlace entre los núcleos de los átomos. Esta información puede ser usada para predecir la estabilidad de los compuestos químicos, así como para determinar la estructura molecular de los compuestos.
Además, los radios atómicos también se usan para determinar la interacción entre los átomos. Esto incluye la forma en que los átomos se atraen y repelen entre sí, así como la forma en que los átomos interactúan con otros átomos. Esta información es importante para entender la reactividad química de los compuestos.
En conclusión, los radios atómicos son una importante herramienta para estudiar la estructura y reactividad de los átomos y compuestos químicos. Estos radios determinan la energía de los átomos, así como las fuerzas de interacción entre los átomos. Esta información es esencial para entender la química básica y los compuestos químicos.
¿Qué elemento tiene el radio atómico más grande?
El elemento con el radio atómico más grande es el Francium (Fr), que es el último elemento en la tabla periódica. Se calcula que el radio atómico del francium es de 270 pm. El radio atómico es una medida de la distancia entre el núcleo de un átomo y sus electrones. En la mayoría de los elementos, el radio atómico aumenta a medida que se desplaza hacia abajo en la tabla periódica, ya que los electrones se agregan a los niveles energéticos más exteriores. El radio atómico también aumenta cuando se desplaza hacia la derecha en la tabla, ya que los núcleos se vuelven más pequeños con el aumento de los números atómicos. El radio atómico es una de las principales características que diferencian los elementos químicos y se usa para predecir las propiedades químicas y físicas de los elementos.
El radio atómico es una de las principales características que diferencian los elementos químicos y se usa para predecir las propiedades químicas y físicas de los elementos. La forma más común de medir el radio atómico es el radio covalente, que mide la distancia entre los núcleos de dos átomos iguales enlazados covalentemente. El radio covalente es generalmente mayor que el radio atómico, ya que el tamaño de los núcleos es menor que el de los electrones. Otra forma de medir el radio atómico es el radio iónico, que mide la distancia entre los núcleos de dos iones cargados. El radio iónico es generalmente menor que el radio atómico, ya que el tamaño de los núcleos es mayor que el de los electrones.
El radio atómico también se usa para predecir otros aspectos de la química, como la solubilidad y la reactividad. La solubilidad de un elemento aumenta a medida que el radio atómico del elemento aumenta. La reactividad de un elemento también se ve afectada por el radio atómico. Los elementos con radios atómicos más grandes son menos reactivos que los elementos con radios atómicos más pequeños.
¿Qué es el radio de Bohr?
El radio de Bohr es una medida del tamaño de los átomos, en particular el radio atómico o radio de la órbita de electrones, descubierto por el físico danes Niels Bohr en 1913. El radio de Bohr se define como la distancia promedio entre el núcleo de un átomo y la órbita de electrones más externa. Esta distancia depende de la cantidad de electrones en la órbita electrónica más externa. Para un átomo neutro, el radio de Bohr es aproximadamente igual al número atómico, es decir, el número de protones en el núcleo, menos uno.
Los radios atómicos son medidas de los tamaños de los átomos y están relacionados con los radios de Bohr. El radio atómico se refiere a la distancia entre el núcleo de un átomo y la órbita de electrones más externa. El radio atómico es aproximadamente igual al radio de Bohr, pero puede variar ligeramente debido a factores como la fuerza nuclear y los efectos electrónicos. El radio atómico es una medida útil para determinar la reactividad de los átomos. Por ejemplo, los átomos con radios atómicos más grandes son más reactivos, mientras que los átomos con radios atómicos más pequeños son menos reactivos.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.