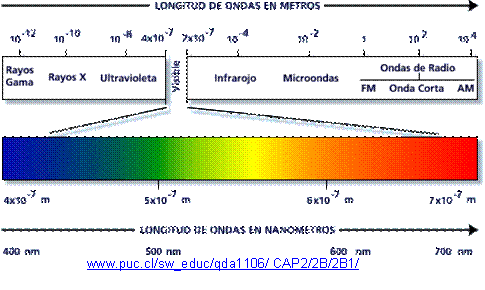
.
Serie espectral es una secuencia de longitudes de onda en la que los átomos de un gas emiten luz. Esta secuencia se encuentra en todos los átomos y es diferente para cada elemento químico. Esta serie espectral fue descubierta por primera vez por el físico alemán Gustav Kirchhoff en el siglo XIX.
En física, la serie espectral se refiere a la línea espectral emitida por el átomo de un elemento químico cuando es excitado. Esta línea espectral está compuesta por un patrón de líneas de absorción y emisión de luz, cada una de las cuales es una longitud de onda distinta. Estas líneas de absorción y emisión se pueden usar para identificar qué elementos químicos están presentes en una muestra.
La serie espectral es una característica única de cada elemento químico y se puede usar para estudiar la estructura de los átomos, así como para identificar qué elementos están presentes en una muestra. Esta serie se usa en muchas áreas de la física, como la astrofísica, la física de partículas y la física atómica. También se usa para estudiar las condiciones del universo e incluso para estudiar la composición química de los planetas.
Fórmula Rydberg
La fórmula Rydberg es una ecuación matemática utilizada para determinar los niveles de energía en los átomos. Esta fórmula fue desarrollada por el físico sueco Johannes Rydberg en 1888. Esta ecuación se utiliza para predecir cuáles serán los niveles de energía de los átomos en un proceso conocido como serie espectral.
La serie espectral está formada por los diferentes niveles de energía de los átomos. Estos niveles se determinan utilizando la fórmula Rydberg. Esta ecuación se basa en los cuatro números principales: el número atómico, el número de masa, la energía de ionización y la energía de enlace. Estos números se utilizan para determinar los niveles de energía de los átomos.
La fórmula Rydberg se escribe como:
E = -R/n²
Donde «E» se refiere a la energía, «R» es el número de Rydberg y «n» es el nivel de energía. Esta fórmula se utiliza para determinar la energía de los niveles de los átomos. Los niveles de energía se usan para predecir las líneas espectrales que se observan al examinar una fuente de luz. Estos patrones de líneas espectrales se utilizan para identificar los átomos en una muestra.
¿Cómo se forman las series espectrales?
Las series espectrales son secuencias de líneas de emisión de luz que forman un patrón único cuando se observa desde la Tierra. Estas líneas se originan en la emisión de energía por los niveles de energía de los átomos o moléculas. Su longitud de onda característica es específica para cada elemento químico o compuesto químico. Estas líneas se detectan a través de espectrómetros y se usan para identificar los elementos químicos presentes en una estrella.
En física, una serie espectral es una secuencia de líneas de emisión de luz que se generan cuando los átomos o moléculas se excitan mecánicamente o cuando se les aplica calor. Estas líneas tienen una longitud de onda característica que es única para cada elemento. Estas líneas se usan para identificar elementos químicos, determinar la temperatura de un objeto, determinar la composición química de una estrella, estudiar los movimientos de los objetos astronómicos y muchas otras aplicaciones.
Las series espectrales se formarán cuando un átomo o molécula absorbe o emite energía. Si la energía absorbida es suficiente, los electrones internos se excitarán y pasarán a un nivel de energía superior. Esta energía adicional puede ser emitida en forma de una línea espectral característica. Estas líneas están relacionadas con los niveles de energía de los electrones y se conocen como series espectrales.
Las series espectrales más comunes son las series de Balmer, Lyman, Paschen, Brackett y Pfund. Estas series se originan en la emisión de energía por los niveles de energía de los átomos o moléculas. Estas líneas se usan para determinar la temperatura de un objeto, determinar la composición química de una estrella y estudiar los movimientos de los objetos astronómicos.
En general, las series espectrales son una herramienta útil para los astrónomos y físicos. Pueden usarse para identificar elementos químicos, determinar la temperatura de un objeto, determinar la composición química de una estrella y estudiar los movimientos de los objetos astronómicos.
Serie Lyman (n l = 1)
Serie Lyman (n l = 1) es una serie espectral de emisión de líneas de emisión óptica usada para estudiar la física del estado excitado de los átomos. Esta serie espectral fue descubierta por Theodore Lyman en 1903. Esta serie se compone de diversas líneas de emisión óptica que se generan cuando los electrones de un átomo caen desde un nivel energético n l = 2 hasta un nivel energético n l = 1. Esta serie se compone de líneas ultravioletas, líneas visibles y líneas infrarrojas. Las líneas de la serie Lyman son importantes para identificar los elementos químicos que se encuentran en el espacio interestelar. Además, estas líneas también pueden usarse para determinar la temperatura y densidad del gas interestelar. Estas líneas son una herramienta útil para entender la química y la física del espacio interestelar.
Serie Balmer (n l = 2)
Serie Balmer (n l = 2) es una serie espectral en física que aparece en la emisión de líneas de absorción y emisión de átomos de hidrógeno. Esta serie espectral está relacionada con los cambios de energía entre los estados energéticos del átomo de hidrógeno.
La serie Balmer es la más conocida y estudiada de todas las series espectrales del hidrógeno, ya que es la primera que fue descubierta en el siglo XIX. Esta serie se produce cuando el electrón de un átomo de hidrógeno pasa del estado excitado n = 3 al estado basal n = 2. Esto se manifiesta como la emisión de luz en forma de líneas espectrales con una longitud de onda característica.
La ecuación de la serie Balmer se denomina ecuación de Balmer-Rydberg y se puede escribir como:
1/λ = R (1/2² – 1/n²)
donde λ es la longitud de onda de la línea espectral emitida, R es la constante de Rydberg y n es el número cuántico principal del estado excitado del átomo de hidrógeno.
Esta ecuación se utiliza para predecir el comportamiento de la serie Balmer para números cuánticos mayores que 2. Esto significa que se pueden predecir con precisión las longitudes de onda de las líneas espectrales emitidas para cualquier estado energético del átomo de hidrógeno.
Además de la serie Balmer, hay otras series espectrales relacionadas con el átomo de hidrógeno, como la serie Lyman, Paschen y Brackett. Estas series se relacionan con los cambios de energía entre los estados energéticos del átomo de hidrógeno, pero no se manifiestan como líneas espectrales visibles.
Serie Paschen (n l = 3)
.
Serie Paschen (n l = 3) es una de las series espectrales de la física de la materia, descrita por el físico alemán Friedrich Paschen en 1908. La «serie Paschen» es una línea espectral emitida por los átomos de hidrógeno que forman parte de una serie de transiciones de energía entre los niveles de energía orbitales del átomo de hidrógeno. Esta serie comprende transiciones del nivel de energía orbital n = 3 al nivel l = 0, 1, 2, y 3. Estas líneas se conocen como Lα, Lβ, Lγ, y Lδ, respectivamente. Estas líneas se identifican como la primera, segunda, tercera y cuarta líneas de la serie Paschen.
La serie Paschen es un tipo de líneas espectrales que se producen cuando un electrón se mueve entre los niveles de energía orbitales del átomo de hidrógeno. La energía involucrada en estas transiciones es igual a la diferencia entre los niveles de energía. Estas líneas se caracterizan por una longitud de onda específica, y pueden ser detectadas en el espectro de luz emitido por un objeto. Estas líneas se usan para determinar la temperatura, densidad y composición química de una región del espacio.
Además, la serie Paschen se usa para caracterizar la estructura interna de los átomos de hidrógeno. Esta información se utiliza para estudiar la estructura de los átomos y el comportamiento de los electrones en el átomo de hidrógeno. Esta información también se usa para estudiar problemas relacionados con la física cuántica, la astronomía y la astrofísica. Esta información también se usa para entender la estructura química de la materia.
Serie Brackett (n l =4)
La Serie Brackett (n l =4) es una serie espectral de líneas de emisión de hidrógeno en la física que se encuentra en la región ultravioleta del espectro. Esta serie es parte de las series espectrales de Balmer, Paschen, Lyman y Brackett, cada una relacionada con el número cuántico angular l. Esta serie está asociada con el número cuántico angular l = 4 y comienza con una transición de energía entre los niveles de energía 4 y 3 del átomo de hidrógeno. Las líneas de esta serie se encuentran aproximadamente entre los 13.6 a 24.4 nm de longitud de onda. Esta serie es particularmente útil para la investigación de fenómenos relacionados con el gas caliente, como el gas en el interior de nebulosas HII. Esta serie se puede utilizar para determinar la temperatura del gas, la densidad y la composición química del gas.
Serie Pfund (n l = 5)
Serie Pfund (n l = 5) es una serie espectral de líneas de emisión de átomos enfocada en la región del ultravioleta. Esta serie específica se relaciona con los estados energéticos del átomo de hidrógeno con n l = 5. Esta serie fue descubierta por el físico alemán August Pfund en 1906.
Las líneas de la serie Pfund se encuentran entre los niveles energéticos 5 y 4 del átomo de hidrógeno, con el estado energético más bajo siendo el nivel 5. Estas líneas espectrales se producen cuando un electrón se ve excitado desde el nivel 5 hasta el nivel 4, y posteriormente se recombina con el núcleo para volver al nivel 5. Esta energía se libera en forma de línea de emisión visible.
Las líneas espectrales de la Serie Pfund son extremadamente finas y están distribuidas entre los longitudes de onda de 3.755 y 3.777 nanómetros. Estas líneas se emiten a temperaturas relativamente bajas, por lo que se encuentran comúnmente en líneas de emisión de nebulosas.
Serie de Humphreys (n l = 6)
Serie de Humphreys: La serie espectral de Humphreys es una serie espectral de líneas de emisión asignada a la energía de los niveles de energía de los átomos. Está compuesta por líneas de emisión asignadas a los niveles de energía de los átomos con nivel principal de energía n = 6. Esta serie se subdivide en seis grupos principales de líneas de emisión, dependiendo del nivel de energía al que pertenecen. Estos grupos son: n = 6 a n = 4, n = 5 a n = 3, n = 4 a n = 2, n = 3 a n = 1, n = 2 a n = 0, y n = 1 a n = 0. Estas líneas de emisión se utilizan en la observación de objetos astronómicos, como nebulosas, para determinar la composición química de los mismos. Esta serie de líneas de emisión también se utiliza en la determinación de velocidades de los objetos astronómicos. Las líneas de emisión de la serie de Humphreys son útiles para detectar los elementos químicos que se encuentran en el medio interestelar. Esta serie es la base para la determinación de la temperatura de los objetos astronómicos.
Mire el video y comprenda la relación entre la frecuencia y la longitud de onda
Serie espectral: La serie espectral es una sucesión de líneas espectrales que aparecen en el espectro de emisión o absorción de un gas o una fuente de luz. Estas líneas están relacionadas con los estados energéticos de los átomos o moléculas y se usan para identificar la composición química de una sustancia.
La frecuencia y la longitud de onda están estrechamente relacionadas entre sí. La frecuencia es la cantidad de veces que una onda se repite por unidad de tiempo, mientras que la longitud de onda es la distancia entre dos crestas consecutivas de una onda. La relación entre la frecuencia y la longitud de onda se expresa mediante la ecuación:
f = c/λ
Donde f es la frecuencia, c es la velocidad de la luz en el vacío y λ es la longitud de onda. Esta relación se conoce como la ley de la frecuencia-longitud de onda.
La serie espectral se refiere a una secuencia de líneas espectrales que se producen cuando un gas o una fuente de luz emiten o absorben luz. Estas líneas están relacionadas con los estados energéticos de los átomos o moléculas y se usan para identificar la composición química de una sustancia. La frecuencia y la longitud de onda de las líneas espectrales están relacionadas entre sí, por lo que se pueden usar para determinar la energía de los átomos y moléculas. Esta información se puede usar para estudiar la estructura de los átomos y moléculas, así como para identificar los elementos presentes en una sustancia.
¿Cuál es el significado de la fórmula de Rydberg?
.
La fórmula de Rydberg es una ecuación matemática descrita por el físico sueco Johannes Rydberg para determinar la frecuencia de la línea espectral de un átomo. Esta fórmula es importante para entender el comportamiento de los átomos en una línea espectral y se usa para predecir el comportamiento de los átomos en la serie espectral. La fórmula de Rydberg establece que la frecuencia de una línea espectral depende de los números cuánticos del átomo con el que se trabaja. Esta ecuación se escribe como:
ν = R (1/n2 – 1/m2)
En esta ecuación, ν es la frecuencia de la línea espectral, R es la constante de Rydberg, n es el número cuántico principal del átomo y m es el número cuántico de la transición. La constante de Rydberg se determina experimentalmente y es igual a 109,737 cm-1.
La fórmula de Rydberg se utiliza para estudiar la serie espectral, que es la línea de luz emitida cuando un átomo salta de un nivel de energía a otro. Estas líneas espectrales se dividen en varias series espectrales, como la serie Lyman, la serie Balmer y la serie Paschen. La fórmula de Rydberg se usa para predecir la frecuencia de estas líneas espectrales y para estudiar cómo los átomos se comportan en estas series espectrales.
¿Qué es una serie espectral?
Una serie espectral es un patrón de líneas de emisión o absorción de luz visible, ultravioleta o rayos X de una fuente en una banda específica del espectro electromagnético. Estas líneas se usan para identificar los elementos químicos contenidos en una estrella o galaxia y para determinar su composición y temperatura. También se usan para medir la velocidad de las estrellas y galaxias, el tamaño de los agujeros negros y la masa de los planetas. La serie espectral se describe mejor en la teoría de radiación de cuerpo negro, que se refiere al patrón de energía emitida por una fuente de luz caliente.
La teoría de cuerpo negro se refiere a la energía emitida por una fuente de luz caliente, como una estrella, una galaxia o una nebulosa. La serie espectral se refiere a la secuencia de longitudes de onda de luz emitidas o absorbidas por una fuente caliente. Estas longitudes de onda se correlacionan con los elementos químicos presentes en la fuente.
Los científicos usan la serie espectral para identificar los elementos químicos presentes en una estrella o galaxia y para medir su temperatura y composición. Se usa también para medir la velocidad de las estrellas y galaxias, el tamaño de los agujeros negros y la masa de los planetas. La serie espectral es una herramienta útil para estudiar el Universo y comprender cómo funciona.
¿Qué es un fotón?
Un fotón es una partícula elemental de la luz, que es una forma de energía electromagnética. Está relacionada con la luz visible, la luz ultravioleta, la luz infrarroja, las microondas, la luz de rayos X y los rayos gamma. Los fotones son los responsables del transporte de la energía electromagnética.
La serie espectral es un concepto clave en la física que se refiere a la forma en que los fotones se dispersan al interactuar con la materia. Cuando los electrones de un átomo reciben energía de los fotones, saltan de un nivel de energía a otro. Esto causa una emisión o absorción característica de luz, lo que produce la serie espectral. La serie espectral se usa para identificar los elementos químicos y conocer la temperatura de los objetos.
¿Cuál es el sistema atómico más simple que se encuentra en el Universo?
El sistema atómico más simple que se encuentra en el Universo es el hidrógeno, el cual está compuesto por un único protón y un electrón. Esta partícula es la más abundante en el espacio, lo que la hace uno de los elementos más importantes para la vida.
En física, la Serie Espectral describe la energía de los electrones y la estructura de los átomos. Estas series están formadas por los niveles de energía en los que los electrones se pueden ubicar alrededor del núcleo atómico.
El hidrógeno es el único átomo que posee una sola línea en su Serie Espectral, debido a la presencia de un solo electrón. Esta línea es conocida como la línea de Balmer y se encuentra en el spectro de luz visible.
¿Quién descubrió la serie Lyman?
John William Strutt, tercer barón Rayleigh, fue un físico británico que descubrió la Serie espectral de Lyman en 1885. Esta serie es una secuencia de líneas de emisión de iones hidrogeno-neutrón que se encuentran en el ultravioleta. Como parte de la Serie espectral de Lyman, se encuentra la línea de emisión Lyman-alpha. Esta línea se caracteriza por una longitud de onda de 121.6 nm, con lo cual se identifica la transición de los niveles energéticos 2 y 1 del átomo de hidrógeno. Esta línea es importante para la ciencia moderna ya que se utiliza como una herramienta de observación para estudiar el Universo. El estudio de la Serie espectral de Lyman es fundamental para comprender la evolución de los objetos astronómicos, principalmente los quasares.
Además de la Serie espectral de Lyman, también se conocen otras series espectrales, como la Serie Balmer, la Serie Paschen, la Serie Brackett y la Serie Humphreys. Estas series se caracterizan por una secuencia de líneas de emisión de iones hidrogeno-neutrón que se encuentran en diferentes regiones del espectro electromagnético. Estas líneas se utilizan para estudiar los objetos astronómicos y comprender mejor el Universo.
¿Cuáles son las principales series espectrales?
.
Serie espectral es una secuencia de líneas espectrales emitidas por una fuente de luz o una molécula que pueden ser usadas para identificar el elemento o la molécula. Estas líneas espectrales se producen cuando los electrones en los átomos o moléculas absorben o emiten energía. Algunos de los principales tipos de series espectrales incluyen la serie Balmer, la serie Lyman, la serie Paschen, la serie Brackett y la serie Pfund.
La serie Balmer es una línea espectral en la región visible del espectro electromagnético. Esta serie espectral se produce cuando los electrones en un átomo de hidrógeno se excitan a niveles de energía mayores para luego volver a niveles de energía menores. Esta serie se llama así por el astrónomo suizo Johann Balmer, quien fue el primero en identificar este patrón en 1885.
La serie Lyman es una serie espectral en la región ultravioleta del espectro electromagnético. Esta línea espectral se produce cuando los electrones en un átomo de hidrógeno se excitan a niveles de energía mayores para luego volver a los niveles de energía más bajos. Esta serie fue descubierta por el astrónomo estadounidense Theodore Lyman en 1903.
La serie Paschen es una serie espectral en la región infrarroja del espectro electromagnético. Esta línea espectral se produce cuando los electrones en un átomo de hidrógeno se excitan a niveles de energía mayores para luego volver a los niveles de energía más bajos. Esta serie fue descubierta por el físico alemán Friedrich Paschen en 1909.
La serie Brackett es una serie espectral en la región infrarroja del espectro electromagnético. Esta línea espectral se produce cuando los electrones en un átomo de hidrógeno se excitan a niveles de energía mayores para luego volver a los niveles de energía más bajos. Esta serie fue descubierta por el físico estadounidense William W. Brackett en 1926.
La serie Pfund es una serie espectral en la región infrarroja del espectro electromagnético. Esta línea espectral se produce cuando los electrones en un átomo de hidrógeno se excitan a niveles de energía mayores para luego volver a los niveles de energía más bajos. Esta serie fue descubierta por el físico alemán August Pfund en 1925.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.