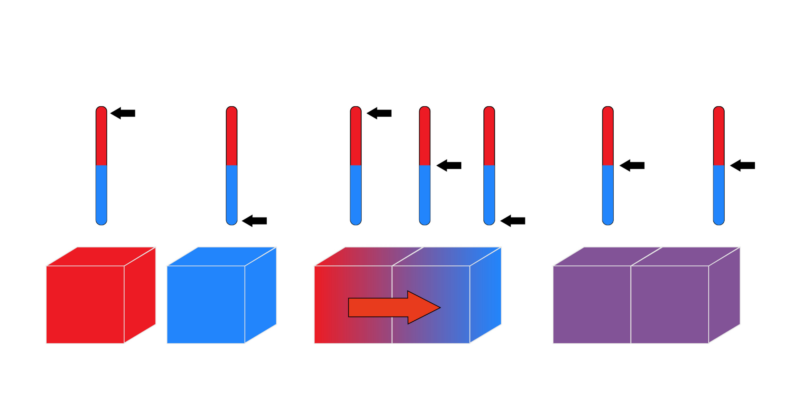
Termodinámica es una rama de la física que trata sobre la relación entre la energía y la temperatura. Esta disciplina se encarga de estudiar los cambios que experimentan los sistemas físicos en relación a la temperatura y al intercambio de energía.
Los principales conceptos de la termodinámica son:
Calor: Es la energía transferida entre sistemas a través de la temperatura.
Entropía: Es una medida de la cantidad de energía disponible para realizar trabajo.
Primera Ley de la Termodinámica: Establece que la energía de un sistema es conservada.
Segunda Ley de la Termodinámica: Establece que la entropía de un sistema aumenta con el tiempo.
Tercera Ley de la Termodinámica: Establece que la entropía de un sistema tiende a un valor máximo a temperatura cero.
Cuarta Ley de la Termodinámica: Establece que la entropía de un sistema es proporcional a la temperatura.
La termodinámica se utiliza para estudiar una amplia variedad de fenómenos físicos, desde el comportamiento de los motores hasta el calentamiento global. Esta disciplina también es importante para la comprensión de la química, la biología y la ingeniería.
¿Qué es la Termodinámica?
La Termodinámica es una rama de la física que estudia los cambios de energía entre sistemas físicos a través de procesos termodinámicos. Estudia los principios fundamentales de la energía, el calor, el trabajo, los cambios de estado, el equilibrio, la entropía y otros conceptos relacionados. Estos principios se aplican a una variedad de sistemas, desde los más simples, como un sistema de moléculas, hasta complejos sistemas astronómicos. La Termodinámica es una herramienta importante para comprender y predecir los procesos físicos en los sistemas en los que se producen estos cambios. La Termodinámica se divide en dos ramas principales: la Termodinámica clásica y la Termodinámica química. La Termodinámica clásica estudia los cambios en la energía de un sistema sin tener en cuenta la química, mientras que la Termodinámica química se ocupa del estudio de los cambios en la energía de un sistema en términos de sus componentes químicos.
Distinción entre mecánica y termodinámica
Mecánica es una de las ramas de la física que se ocupa de la descripción del movimiento de los cuerpos y del estudio de sus leyes. La mecánica estudia la relación entre la fuerza y el movimiento. Se centra en conceptos como la energía, la fuerza, el momento de la fuerza, el trabajo y el impulso.
Termodinámica es una rama de la física que estudia el comportamiento de los sistemas en el equilibrio y fuera del equilibrio. Esta área de la física se centra en los conceptos de energía, entropía, temperatura y presión. Esta ciencia se utiliza para comprender el comportamiento de los sistemas a escalas macroscópicas y también se emplea en la comprensión de los procesos a nivel microscópico.
La termodinámica es una extensión de la mecánica, ya que se ocupa de los conceptos de la mecánica, como la energía, la fuerza y el trabajo, pero también aborda los conceptos adicionales de la entropía, la temperatura y la presión. La mecánica se centra en los conceptos de energía y fuerza, mientras que la termodinámica se centra en los conceptos de entropía, temperatura y presión.
Cronología de la termodinámica
Cronología de la Termodinámica
1650 – El físico francés Denis Papin inventa el primer motor de vapor.
1724 – El físico alemán Gabriel Fahrenheit inventa el termómetro de mercurio.
1733 – El químico y físico alemán Georg Ernst Stahl desarrolla la teoría del fuego, donde propone que el fuego es una mezcla de aire y una «sustancia inflamable».
1748 – El físico alemán Daniel Bernoulli publica su trabajo «Hydrodynamica», donde establece la primera ley de la Termodinámica.
1780 – El químico francés Antoine Lavoisier publica su trabajo «Mécanique des Fluides», estableciendo la segunda ley de la Termodinámica.
1824 – El químico alemán Julius Robert Mayer publica su trabajo «Die Mechanische Warmetheorie», estableciendo la ley de conservación de la energía.
1850 – El físico británico James Prescott Joule publica su trabajo «On the Mechanical Equivalent of Heat», estableciendo la tercera ley de la Termodinámica.
1877 – El físico alemán Rudolf Clausius publica su trabajo «Ueber die bewegende Kraft der Wärme und die Gesetze welche sich daraus für die Wärmelehre selbst ableiten lassen», estableciendo la teoría de la entropía.
1887 – El químico alemán Walther Hermann Nernst publica su trabajo «The Thermal Equilibrium of Chemical Substances», estableciendo la ley de los estados finales.
Diferentes ramas de la termodinámica
Termodinámica: La termodinámica es una rama de la física que estudia el comportamiento macroscópico de los sistemas físicos en términos de energía, trabajo, entropía y otros parámetros relacionados. Esta rama de la física se aplica a una variedad de situaciones, desde la mecánica clásica hasta la química y la física nuclear.
Ramas de la termodinámica: La termodinámica se divide en dos ramas principales: la termodinámica clásica y la termodinámica estadística. La termodinámica clásica se basa en las leyes de la termodinámica y estudia los sistemas a nivel macroscópico. La termodinámica estadística se basa en la mecánica estadística y estudia los sistemas a nivel microscópico. También hay algunas ramas relacionadas, como la termoquímica, la termodinámica de los fluidos, la termodinámica de los materiales y la termodinámica de los sistemas abiertos.
Termodinámica clásica: La termodinámica clásica se basa en los principios de la termodinámica, que establecen que la energía se conserva y que el estado de un sistema está determinado por su energía interna. Esta rama se ocupa de estudiar los cambios en el estado de un sistema cuando se le aplica trabajo y calor. Estudia cómo se comportan los sistemas en términos de presión, volumen, temperatura, entropía y otros parámetros relacionados.
Termodinámica Estadística: La termodinámica estadística se basa en la mecánica estadística, que estudia los sistemas a nivel microscópico. Esta rama se ocupa de estudiar cómo se comportan los sistemas a nivel molecular, y cómo estos comportamientos afectan los cambios macroscópicos en el sistema. Esta rama también estudia la distribución de la energía entre los diferentes grados de libertad del sistema.
Termodinámica Clásica
Termodinámica Clásica es una rama de la Termodinámica, una parte de la Física que estudia el comportamiento de los gases y los líquidos a diferentes temperaturas y presiones. La Termodinámica Clásica se ocupa de los principios básicos de la Termodinámica, tales como la Ley de los Gases Ideales, la Ley de los Gases Perfeccionados y la Ley de los Gases Reales. También se ocupa de los conceptos fundamentales de la termodinámica, como el calor, el trabajo, la energía interna y la entropía.
La Termodinámica Clásica se centra en la descripción de los cambios de estado de la materia y del calor. Estudia cómo la energía, la materia y el calor se interrelacionan entre sí para producir diferentes fenómenos físicos. Los principios básicos de la Termodinámica Clásica son la Ley de los Gases Ideales, la Ley de los Gases Perfeccionados y la Ley de los Gases Reales. Estos principios describen cómo la presión, la temperatura y la densidad de los gases se relacionan entre sí.
La Termodinámica Clásica también se ocupa de los conceptos fundamentales de la termodinámica, como el calor, el trabajo, la energía interna y la entropía. Estos conceptos se relacionan entre sí para describir los cambios de estado de la materia. La entropía es una medida de la cantidad de desorden en un sistema, que es una medida del grado de desorganización de la materia.
La Termodinámica Clásica también se ocupa de los sistemas termodinámicos, que son los objetos o sistemas que estudia la Termodinámica. Un sistema termodinámico se compone de una cantidad de materia y energía. La energía se puede transferir entre los componentes del sistema a través de procesos como la conducción, la convección y la radiación. Estas transferencias de energía se describen mediante las ecuaciones de la Termodinámica.
La Termodinámica Clásica se aplica a una amplia variedad de campos, desde los motores de combustión interna hasta la producción de electricidad. También se usa para estudiar los cambios en la composición química de un sistema, como la combustión de un combustible, el proceso de oxidación, la disolución de una sustancia en un líquido o el proceso de neutralización.
Termodinámica Estadística
Termodinámica Estadística es una rama de la física que se enfoca en el estudio de la relación entre la termodinámica y la estadística mecánica. Esta subdisciplina se concentra en el entendimiento de los comportamientos de los sistemas macroscópicos a partir de la distribución de energía entre sus partículas subatómicas. La termodinámica estadística se utiliza para descubrir la probabilidad de una configuración dada en un sistema microscópico. Estudia, por ejemplo, la distribución de energía en un gas, en función de la temperatura.
Las leyes de la termodinámica se basan en la energía y sus relaciones con el calor y el trabajo. Estas relaciones son fundamentales para comprender los conceptos básicos de la termodinámica estadística. La termodinámica estadística se ocupa de la cantidad de energía disponible para los sistemas microscópicos, y como esta energía influye en el comportamiento macroscópico de los mismos. Esta disciplina se centra en el estudio de los sistemas en equilibrio, en los que la energía es estable y la temperatura es constante.
La termodinámica estadística se utiliza para predecir el comportamiento de los sistemas macroscópicos en función de sus propiedades microscópicas. Esta disciplina se utiliza para comprender los conceptos fundamentales de la física, tales como el calor, el trabajo, el equilibrio y la entropía. Además, la termodinámica estadística se utiliza para predecir el comportamiento de los sistemas macroscópicos en función de la distribución de energía entre sus partículas subatómicas.
termodinámica química
Termodinámica Química es una rama de la química que se ocupa de la relación entre la energía y los sistemas químicos. Estudia cómo la energía se transfiere entre los sistemas químicos a través de procesos químicos y cómo esta energía afecta el comportamiento de los sistemas químicos. Esta disciplina se relaciona estrechamente con la termodinámica de la física, que se ocupa de la interacción entre la energía y los sistemas físicos. La termodinámica química se utiliza para predecir los resultados de los procesos químicos, como la reacción química, la solubilidad, la separación de mezclas y el equilibrio químico.
La termodinámica química se basa en los principios de la termodinámica de la física. Estos principios son los principios de conservación de la energía, la entropía y la energía libre. Estos principios se aplican a los sistemas químicos para predecir cómo la energía y los productos químicos interactúan. Se puede utilizar para calcular el cambio de energía de un proceso químico, la energía de activación de una reacción química y la energía de enlace de los productos químicos.
La termodinámica química se puede usar para predecir el equilibrio químico de una reacción y cómo los cambios en la temperatura, presión o concentración afectan el equilibrio. Esta disciplina se utiliza para estudiar cómo los cambios en el entorno afectan el comportamiento de los sistemas químicos. La termodinámica química también se utiliza para predecir la cantidad de energía liberada durante una reacción química y cómo la energía afecta la velocidad de la reacción.
Termodinámica del equilibrio
La Termodinámica es una rama de la física que estudia los intercambios de energía entre sistemas y su relación con las propiedades macroscópicas de la materia. Esta energía se puede transferir en forma de calor, energía mecánica, radiación electromagnética, etc. La Termodinámica se especializa en la descripción de los cambios de estado en los sistemas.
El equilibrio termodinámico es un estado en el que los sistemas alcanzan un estado de estabilidad. Esto significa que los sistemas se encuentran en un estado en el que los cambios en las propiedades físicas como la temperatura, la presión, la energía, etc. son los mismos en todas las partes. Esto se debe a que la energía total del sistema está en un estado de equilibrio. Esto significa que la energía entrante es igual a la salida.
La Termodinámica del equilibrio se refiere al estudio de los sistemas termodinámicos en los que la energía entrante es igual a la salida. Esto se conoce como el principio de conservación de la energía. Esto significa que si un sistema se encuentra en equilibrio, no hay cambios en sus propiedades. El equilibrio termodinámico se puede lograr a través de la termodinámica. Esto se logra al aplicar los principios de la termodinámica para determinar las variables termodinámicas en un sistema. Estas variables incluyen la temperatura, la presión, la densidad, la energía, etc.
En el equilibrio termodinámico, los cambios en una variable termodinámica son compensados por los cambios en otra variable. Esto significa que los cambios en una variable no afectan a la otra. Esto se conoce como el principio de estado estacionario. Esto significa que un sistema se encuentra en equilibrio cuando las variables termodinámicas permanecen constantes.
La Termodinámica del equilibrio también se utiliza para estudiar los cambios en los sistemas termodinámicos. Esto se logra utilizando los principios de la termodinámica para predecir los cambios en el sistema. Esto significa que los cambios en una variable termodinámica se pueden determinar a partir de los cambios en otra variable. Esto se conoce como el principio de reversibilidad. Esto significa que un sistema se encuentra en equilibrio cuando todos los cambios se pueden revertir.
En el equilibrio termodinámico, los sistemas se encuentran en un estado de estabilidad. Esto significa que los cambios en una variable no afectan a la otra. Esto se conoce como el principio de equilibrio. Esto significa que un sistema se encuentra en equilibrio cuando las variables se mantienen constantes.
Conceptos Básicos de Termodinámica – Términos Termodinámicos
Termodinámica es una rama de la física que estudia las relaciones entre la energía, el trabajo, la entropía, y las leyes de la conservación de la energía. Esta rama se ocupa de los cambios que ocurren en el estado de un sistema físico a medida que cambia la temperatura, la presión, el volumen, la cantidad de materia, etc. Los conceptos básicos de termodinámica incluyen trabajo, energía, presión, temperatura, entropía, calor, capacidad térmica, presión de vapor, energía interna, entalpía, energía libre de Gibbs, entropía libre de Gibbs, entropía de entalpía y sistemas abiertos, cerrados y aislados.
Los términos termodinámicos se utilizan para describir estos conceptos. Los términos más comunes son calor, temperatura, presión, trabajo, energía, entropía, entalpía y energía libre de Gibbs. El calor es la energía transferida entre objetos a diferentes temperaturas. La temperatura es la medida de la energía cinética media de las partículas de un objeto. La presión es la fuerza por unidad de área. El trabajo es la energía transferida por una fuerza. La energía es la capacidad de realizar trabajo. La entropía es una medida del desorden del sistema. La entalpía es la suma de la energía interna y el trabajo. La energía libre de Gibbs es la energía disponible para realizar trabajo en un sistema a presión y temperatura constantes. La entropía libre de Gibbs es una medida de la cantidad de entropía que se puede generar en un sistema a presión y temperatura constantes. La entropía de entalpía es la entropía de un sistema a presión y temperatura constantes. Los sistemas abiertos, cerrados y aislados son los tres tipos de sistemas termodinámicos.
Sistemas Termodinámicos
Sistemas Termodinámicos se refiere a un conjunto de unidades físicas (tales como una cantidad de calor, masa y energía) que están en interacción con el entorno y con otros sistemas. Estas unidades están estrechamente relacionadas con la termodinámica, la ciencia que estudia los cambios en el estado de un sistema debido a la transferencia de calor, trabajo y energía. La termodinámica estudia cómo cambia la energía interna, entalpía, entropía y otros parámetros de un sistema cuando hay un intercambio de calor, trabajo o energía entre el sistema y el entorno. La termodinámica también estudia cómo la energía se transforma entre los diferentes componentes de un sistema.
Los sistemas termodinámicos se clasifican según el número de componentes en el sistema y el tipo de interacción entre ellos. Un sistema típico puede contener componentes tales como calor, trabajo, energía y materia. Estos componentes pueden interactuar entre sí en una variedad de formas, como el flujo de calor, el flujo de trabajo, el flujo de energía y el flujo de materia.
Los sistemas termodinámicos pueden estar en un estado de equilibrio o en un estado de desequilibrio, dependiendo de la cantidad de interacción entre los componentes. Cuando un sistema está en equilibrio, significa que la energía interna, entalpía y entropía del sistema permanecen constantes. En un sistema en desequilibrio, hay una transferencia continua de energía, entalpía y entropía entre los componentes.
Los sistemas termodinámicos también se suelen clasificar según el número de estados en los que se encuentran. Los sistemas isobáricos, isocóricos, isotermas y adiabáticos son ejemplos de sistemas termodinámicos de un estado. Los sistemas cíclicos son sistemas termodinámicos que pasan por varios estados antes de volver al estado inicial.
Los sistemas termodinámicos se utilizan en una amplia variedad de aplicaciones, desde la fabricación de productos hasta la generación de energía. Los principios de la termodinámica se utilizan para diseñar procesos industriales, calentadores solares, máquinas de combustión interna y otras aplicaciones. Los principios de la termodinámica también se utilizan en la ingeniería de combustibles para diseñar sistemas de combustión más eficientes.
Sistema
Sistema Termodinámico: es un sistema físico compuesto por un conjunto de partículas físicas sometidas a interacciones entre sí y con su entorno, y que puede ser estudiado mediante la termodinámica. Un sistema termodinámico es cualquier parte o región de un espacio de configuración físico que se estudia de forma independiente. Un sistema termodinámico se caracteriza por su estado termodinámico, que es el conjunto de sus propiedades termodinámicas como la presión, volumen, temperatura, energía, entropía, etc. Un sistema termodinámico puede estar sometido a cambios termodinámicos, los cuales pueden ser la adición o extracción de energía, cambios en la presión o volumen, etc.
La termodinámica es una rama de la física que estudia los cambios físicos que ocurren dentro de los sistemas termodinámicos. Esta ciencia se ocupa de cómo estos cambios afectan a la energía, la entropía, la temperatura y la presión. Los principios básicos de la termodinámica se relacionan con la energía y la entropía y estos principios se aplican a todos los sistemas termodinámicos. La termodinámica se ocupa de los cambios que ocurren dentro de los sistemas termodinámicos y cómo estos cambios afectan a la energía, la entropía, la temperatura y la presión. Los principios básicos de la termodinámica se relacionan con la energía, el trabajo y la entropía y estos principios se aplican a todos los sistemas termodinámicos.
Circundante
Circundante: En termodinámica, el concepto de circundante se refiere al medio ambiente estático de un sistema, en el que está contenido. Esto incluye el entorno físico y químico, así como cualquier cambio de estado que tenga lugar dentro del sistema. El concepto de circundante se usa para referirse a la influencia de factores externos en el sistema, como la temperatura, la presión, la concentración de sustancias químicas, la velocidad de flujo de fluidos y otros. La circundante proporciona información importante sobre los procesos termodinámicos que tienen lugar dentro del sistema, como el calor, la energía y los cambios químicos. El concepto de circundante es importante en la comprensión de la termodinámica, ya que los procesos termodinámicos a menudo dependen de la influencia de la circundante.
Proceso Termodinámico
Proceso Termodinámico es un término usado en Termodinámica, la cual es una rama de la física que estudia los cambios de energía entre sistemas físicos. Un proceso termodinámico es la transformación de energía térmica en trabajo o energía potencial, así como la transferencia de calor entre sistemas. Los procesos termodinámicos se clasifican como adiabáticos, isobáricos, isocóricos, isotermal y otros.
Un proceso adiabático es aquel en el que no hay transferencia de calor entre los sistemas. Esto significa que toda la energía térmica se convierte en energía potencial. Un ejemplo de proceso adiabático es el ciclo de Carnot.
Un proceso isobárico se caracteriza por una presión constante en todas las fases del proceso. Esto significa que el volumen puede cambiar, pero la presión se mantendrá constante. Un ejemplo de proceso isobárico es la distribución de gas en un contenedor.
Un proceso isocórico se caracteriza por un volumen constante en todas las fases del proceso. Esto significa que la presión puede cambiar, pero el volumen se mantendrá constante. Un ejemplo de proceso isocórico es el enfriamiento de un gas.
Un proceso isotermo es aquel en el que la temperatura se mantiene constante en todas las fases del proceso. Esto significa que la presión y el volumen pueden cambiar, pero la temperatura se mantendrá constante. Un ejemplo de proceso isotermo es el calentamiento de un gas.
Los procesos termodinámicos son importantes para entender los cambios de energía en los sistemas físicos. Estos procesos se utilizan en muchos campos de la ingeniería, como la ingeniería mecánica, eléctrica, química, nuclear y aeronáutica.
Equilibrio termodinámico
Equilibrio Termodinámico es un concepto utilizado en Termodinámica, la cual es una rama de la física que se ocupa del estudio de los cambios de energía en un sistema. El equilibrio termodinámico es un estado de un sistema en el que no hay cambios en sus propiedades físicas, tales como temperatura, presión, volumen, etc. Esto significa que el sistema está en un estado estable, en el que el intercambio de energía entre los componentes del sistema es igual.
El equilibrio termodinámico de un sistema se puede lograr de varias maneras. Una de ellas es mediante el ajuste de una combinación de propiedades físicas del sistema, como la temperatura y la presión. Otro método es mediante la adición de energía al sistema hasta que se alcance el equilibrio. Esto se conoce como el principio de la entropía, que dice que para lograr el equilibrio termodinámico, la entropía total del sistema debe ser mínima.
Una vez que se alcanza el equilibrio termodinámico, el sistema se encuentra en un estado de estabilidad. Esto significa que cualquier cambio en la temperatura, presión o volumen del sistema no tendrá ningún efecto sobre el equilibrio. El equilibrio termodinámico también se conoce como punto de equilibrio, ya que representa el punto en el que el sistema se estabiliza.
El equilibrio termodinámico es un concepto importante en la física, ya que permite entender mejor cómo funciona el universo. El equilibrio es un principio clave en la teoría científica, ya que permite entender cómo los sistemas físicos se comportan en diferentes condiciones. Esto es especialmente cierto para los sistemas en los que existe una gran cantidad de energía, como los sistemas astronómicos o los sistemas químicos.
Propiedades termodinámicas
Propiedades Termodinámicas: son magnitudes físicas que se utilizan para caracterizar un sistema en equilibrio termodinámico. Las propiedades termodinámicas principales son la temperatura, la entalpía, la energía interna, el trabajo y el calor.
Temperatura: es una magnitud física que mide la cantidad de calor que hay en un sistema. Se mide en grados Kelvin (K) o en grados Celsius (°C).
Entalpía: es una magnitud física que mide la cantidad de energía interna de un sistema. Se mide en Joules (J) o en Calorías (cal).
Energía Interna: es una magnitud física que mide la cantidad de energía que hay en un sistema. Se mide en Joules (J) o en Calorías (cal).
Trabajo: es una magnitud física que mide la cantidad de energía transferida entre dos sistemas. Se mide en Joules (J) o en Calorías (cal).
Calor: es una magnitud física que mide la cantidad de energía transferida entre dos sistemas. Se mide en Joules (J) o en Calorías (cal).
En la termodinámica, se estudia cómo los sistemas interactúan con el calor y el trabajo, cómo los sistemas aumentan o disminuyen su energía interna y cómo se relacionan entre sí sus propiedades termodinámicas. El estudio de la termodinámica nos ayuda a entender mejor el comportamiento de los sistemas en diversas situaciones.
¿Qué es la entalpía?
.
La entalpía es un concepto de la Termodinámica que mide el contenido de energía interna de un sistema. Esta energía interna está compuesta por la energía cinética y la energía potencial del sistema. La entalpía se representa por la letra H y se mide en Joules (J).
Se define como la energía de un sistema termodinámico que es capaz de realizar trabajo mediante procesos reversibles. Esta energía también se conoce como contenido interno de energía, energía de composición, energía de configuración, entropía interna y energía de Gibbs.
La entalpía se utiliza para calcular el cambio de energía en un proceso termodinámico en el que el sistema cambia de estado. Esto se conoce como entalpía de formación o entalpía de transformación. Los cambios de entalpía se calculan mediante la ecuación de la entalpía:
ΔH = q + w
En la ecuación anterior, q representa la cantidad de calor intercambiado entre el sistema y su entorno, mientras que w representa el trabajo realizado por el sistema.
Los cambios de entalpía se utilizan para estudiar los procesos termodinámicos, como la combustión, la mezcla de disolventes, la evaporación, la destilación y la condensación. Los cambios de entalpía también se utilizan para calcular la cantidad de energía necesaria para llevar a cabo una reacción química.
¿Qué es la entropía?
La entropía es una magnitud termodinámica que mide el grado de desorden de un sistema. Esta magnitud se relaciona con la termodinámica porque su variación está relacionada con la cantidad de energía que un sistema puede intercambiar con el exterior. La entropía nos permite medir el grado de desorden de un sistema, es decir, la cantidad de energía dispersa en el mismo. Esta magnitud también nos permite determinar la entalpía, que es la cantidad total de energía liberada en un proceso termodinámico. La entropía es una magnitud termodinámica que se aplica a diversos sistemas, como la mecánica, la electricidad, la termodinámica, etc. Esta magnitud se relaciona con la termodinámica porque permite medir el grado de desorden de un sistema, es decir, la cantidad de energía dispersa en el mismo. Además, la entropía también nos permite determinar la entalpía, que es la cantidad total de energía liberada en un proceso termodinámico. Por lo tanto, la entropía es una magnitud muy importante para entender los fenómenos físicos y poder predecir los resultados de los mismos.
Potenciales Termodinámicos
Potenciales Termodinámicos: uno de los principales conceptos de la termodinámica es el potencial termodinámico, que se refiere a la cantidad de energía potencial que puede ser liberada por un sistema a través de un proceso termodinámico. Los potenciales termodinámicos son medidas de energía que se pueden liberar por un sistema en respuesta a un proceso externo. Estos potenciales pueden ser medidos como energía química, energía térmica, energía eléctrica, energía mecánica, etc.
En términos generales, un potencial termodinámico es una medida de la energía que se puede extraer de un sistema termodinámico al someterlo a un proceso externo. Esta energía puede ser recuperada en forma de calor, trabajo o cualquier otra forma de energía. Por lo tanto, los potenciales termodinámicos se refieren a la cantidad de energía que se puede obtener del sistema al someterlo a un proceso externo.
Los potenciales termodinámicos son medidas de la energía que se puede liberar del sistema al someterlo a un proceso externo. Por ejemplo, en un sistema termodinámico, la energía química se libera cuando un compuesto químico reacciona con otro. Esta energía puede ser medida como el potencial químico del sistema. Del mismo modo, la energía térmica se libera cuando un sistema se calienta o enfría. Esta energía se puede medir como el potencial térmico del sistema.
Los potenciales termodinámicos son importantes para entender cómo un sistema responde a un proceso externo. Estos potenciales pueden ser determinados mediante experimentos, cálculos y simulaciones numéricas. Esta información puede ayudar a los científicos y tecnólogos a comprender mejor los procesos termodinámicos y a diseñar sistemas más eficientes.
Problemas Resueltos de Termodinámica
Problemas Resueltos de Termodinámica
La termodinámica es una de las ramas de la física que estudia el comportamiento de los sistemas termodinámicos. Estudia los cambios en la energía interna, la entalpía, la entropía y otros parámetros relacionados. A través de la termodinámica se pueden resolver problemas relacionados con la conversión de energía térmica en trabajo, el movimiento de calor, la eficiencia de los motores, entre otros.
Los problemas de termodinámica se pueden resolver utilizando los principios termodinámicos. El primer principio de la termodinámica establece que la energía de un sistema termodinámico no se puede crear ni destruir, sino que sólo se puede transformar de una forma a otra. El segundo principio de la termodinámica establece que todos los procesos termodinámicos se realizan de la misma forma en todos los sentidos, es decir, que los procesos son reversibles. El tercer principio de la termodinámica establece que la entropía de un sistema cerrado siempre aumenta.
Para resolver problemas de termodinámica, es importante entender los principios termodinámicos y cómo se aplican a los sistemas. Una vez que se entienden los principios, se puede aplicar la ecuación de estado para calcular la entalpía, la entropía y otros parámetros relacionados con el sistema.
Además, se pueden usar modelos matemáticos para resolver problemas de termodinámica. Estos modelos matemáticos pueden ser usados para encontrar la energía interna, la entalpía, la entropía, el calor específico y otros parámetros relacionados con el sistema.
Por último, se puede usar la termodinámica para calcular la eficiencia de los motores y las máquinas térmicas. Esto se hace mediante el uso de la ley de Carnot, que establece que la eficiencia de una máquina térmica es igual al cociente entre la temperatura de salida y la temperatura de entrada.
En resumen, los problemas de termodinámica se pueden resolver utilizando los principios termodinámicos, ecuaciones de estado y modelos matemáticos. Esto permite calcular la energía interna, la entalpía, la entropía, el calor específico y la eficiencia de los motores y máquinas térmicas.
Leyes de la Termodinámica
Las Leyes de la Termodinámica son un conjunto de principios fundamentales que describen los cambios en la energía interna de un sistema cerrado. Estas leyes se aplican a todos los sistemas físicos, desde los sistemas moleculares hasta los sistemas astronómicos. La Termodinámica es la rama de la física que estudia la manera en que la energía se transfiere entre los sistemas a través del calor y el trabajo.
Primera Ley de la Termodinámica: Esta ley establece que la energía total de un sistema cerrado es constante. Esto significa que la energía no se crea ni se destruye, sino que se conserva y se transfiere de un sistema a otro.
Segunda Ley de la Termodinámica: Esta ley se refiere a la entropía, que es una medida de la desorganización de un sistema. Esta ley establece que la entropía de un sistema cerrado siempre aumenta con el tiempo. Esto significa que los sistemas tienden a un estado de desorden, aunque la energía se conserve.
Tercera Ley de la Termodinámica: Esta ley establece que la entropía de un sistema termodinámico en equilibrio tiende a un valor máximo. Esto significa que los sistemas tienden a un estado de equilibrio, en el que la entropía es máxima.
Las Leyes de la Termodinámica son importantes en la física porque ayudan a explicar los cambios en la energía interna de los sistemas y los procesos que conducen a su equilibrio. Estas leyes son útiles para comprender la transferencia de energía entre los sistemas, así como el comportamiento de los sistemas en su estado de equilibrio.
¿Cuántas leyes de la termodinámica hay?
Leyes de la Termodinámica:
La Termodinámica es una parte de la Física que estudia los procesos en los que se intercambia energía térmica entre sistemas. Existen 4 leyes principales de la Termodinámica que describen los cambios que ocurren en los sistemas termodinámicos. Estas leyes son:
Primera Ley de la Termodinámica: Esta ley establece que la energía de un sistema termodinámico es una constante. Esto quiere decir que la energía no se crea ni se destruye, sino que siempre se conserva.
Segunda Ley de la Termodinámica: Esta ley establece que la entropía de un sistema termodinámico aumenta con el tiempo. Esto significa que los sistemas tienden hacia un estado de desorden, y que la energía se disipa con el tiempo.
Tercera Ley de la Termodinámica: Esta ley establece que la entropía de un sistema a temperatura absoluta cero es una constante. Esto significa que a temperaturas cercanas a cero, la entropía de un sistema no cambiará.
Cuarta Ley de la Termodinámica: Esta ley establece que la entropía de un sistema termodinámico es una función de la energía interna del sistema y la temperatura absoluta. Esto significa que si la energía interna y la temperatura de un sistema cambian, la entropía también cambiará.
En resumen, hay cuatro leyes principales de la Termodinámica que describen los cambios que ocurren en los sistemas termodinámicos. Estas leyes son: la Primera Ley de la Termodinámica, que establece que la energía de un sistema es una constante; la Segunda Ley de la Termodinámica, que establece que la entropía de un sistema aumenta con el tiempo; la Tercera Ley de la Termodinámica, que establece que la entropía de un sistema a temperatura absoluta cero es una constante; y la Cuarta Ley de la Termodinámica, que establece que la entropía de un sistema termodinámico es una función de la energía interna del sistema y la temperatura absoluta.
Ley cero de la termodinámica
.
Ley cero de la termodinámica: La ley cero de la termodinámica es una ley básica de la termodinámica que afirma que si un sistema se somete a un proceso cíclico, el cambio total de energía interna del sistema es igual a cero. Esta ley se conoce comúnmente como la ley de conservación de energía, ya que indica que la energía interna de un sistema es una propiedad conservada. Esta ley se deriva generalmente de la primera ley de la termodinámica, la cual afirma que la energía interna del sistema es constante, a menos que se suministre o retire energía al sistema.
La ley cero de la termodinámica se deriva de la segunda ley de la termodinámica, que afirma que el cambio en la entropía de un sistema cerrado es siempre mayor o igual que cero. Esto significa que el cambio en la entropía es igual a cero si el sistema se somete a un proceso cíclico. Como la entropía es una función de estado, el cambio en la entropía debe ser igual a cero. Esto, a su vez, implica que el cambio en la energía interna del sistema también es igual a cero, ya que la energía interna es una función de estado.
En resumen, la ley cero de la termodinámica afirma que el cambio en la energía interna de un sistema es igual a cero cuando se somete a un proceso cíclico. Esta ley es una extensión de la primera ley de la termodinámica, que afirma que la energía interna es una propiedad conservada. Esta ley es esencial para entender y calcular el comportamiento de los sistemas termodinámicos.
Un ejemplo que demuestra la Ley Cero
La Ley Cero de la Termodinámica se refiere a la primera ley de la termodinámica, también conocida como la ley de la conservación de la energía. Esta ley establece que la energía no puede ser creada ni destruida. Señala que la energía se puede transferir y cambiar de forma, pero la cantidad total de energía permanece constante.
Un ejemplo de la Ley Cero de la Termodinámica es una batería. La energía de la batería se transfiere de la batería al dispositivo que está alimentando. Esta energía se utiliza para alimentar el dispositivo, pero la cantidad total de energía en el sistema permanece constante. Si el dispositivo consume toda la energía de la batería, la batería quedará vacía y no tendrá energía para alimentar el dispositivo. Esto demuestra la Ley Cero de la Termodinámica, ya que aunque la energía se transfiere de un lugar a otro, la cantidad total de energía se mantiene constante.
Primera Ley de la Termodinámica
La Primera Ley de la Termodinámica es una ley básica de la ciencia de la termodinámica que describe el principio de conservación de la energía. Esta ley establece que la energía total de un sistema aislado es constante. Esto significa que la energía no se crea ni se destruye, sino que se transforma de una forma a otra. Esta ley es una de las leyes más importantes de la física y se aplica a todos los sistemas físicos, desde los atómicos hasta los astronómicos.
La Primera Ley de la Termodinámica se deriva de la Ley de la Conservación de la Energía, que dice que la energía total de un sistema cerrado no cambia. Esta ley establece que el cambio en la energía interna de un sistema aislado es igual a la energía que entra menos la energía que sale del sistema. Esto significa que la energía se mantiene constante en el sistema, ya sea en forma de calor o trabajo.
La Primera Ley de la Termodinámica también establece que el aumento de la temperatura de un sistema aislado es directamente proporcional al calor que se suministra al sistema. Esta relación se conoce como la Ley de Calorímetro. Esta ley es la base para el principio de conservación de energía, ya que establece que el calor suministrado al sistema se convierte en energía interna.
La Primera Ley de la Termodinámica también se aplica a los procesos de expansión de gases, donde se dice que el trabajo realizado por un gas es igual a la energía transferida al gas. Esta ley se conoce como la Ley de Boyle-Mariotte. Esta ley se aplica a los procesos de expansión de gases, ya que establece que el trabajo realizado por un gas es igual a la energía transferida al gas.
Ejemplos de la primera ley de la termodinámica:
La Primera Ley de la Termodinámica es un principio fundamental en física que establece que la energía de un sistema cerrado se conserva. Esto significa que la energía no se crea ni se destruye, sino que simplemente se transforma de una forma a otra. Esta ley se aplica a cualquier sistema termodinámico, que es cualquier sistema que involucre intercambio de calor y trabajo.
Algunos ejemplos de la primera ley de la termodinámica incluyen:
• El calor que se transfiere entre dos sistemas en equilibrio térmico. Cuando dos sistemas están en equilibrio térmico, la cantidad de calor transferido entre ellos debe ser igual a la energía interna de los sistemas.
• La energía interna de un sistema. La energía interna de un sistema es la cantidad de energía que contiene el sistema en función de sus propiedades termodinámicas, como la temperatura, presión y volumen. La energía interna no se crea ni se destruye, sino que simplemente cambia de una forma a otra.
• El trabajo realizado por un sistema. El trabajo realizado por un sistema es la transferencia de energía que se produce cuando el sistema realiza una acción, como expandirse o contrarse. El trabajo realizado por un sistema es igual a la energía interna cambiada por el sistema.
• El calor transferido a un sistema. El calor transferido a un sistema es igual a la energía interna cambiada por el sistema. El calor transferido a un sistema aumenta su energía interna, mientras que el calor transferido desde un sistema disminuye su energía interna.
En conclusión, la Primera Ley de la Termodinámica es un principio fundamental en la física que establece que la energía de un sistema cerrado se conserva. Esta ley se aplica a cualquier sistema termodinámico y se refleja en varios ejemplos, como el calor transferido entre dos sistemas en equilibrio térmico, la energía interna de un sistema, el trabajo realizado por un sistema y el calor transferido a un sistema.
Segunda Ley de la Termodinámica
Segunda Ley de la Termodinámica: Esta Ley establece que la entropía de un sistema aislado siempre aumenta. Esto significa que la cantidad de energía disponible para realizar trabajo en un sistema es cada vez menor. Esto se debe a que la energía se transfiere de un sistema a otro, perdiéndose parte de la energía en forma de calor. Esto se conoce como el Principio de Degradación de la Energía. Esta Ley establece que la entropía total de un sistema aislado permanecerá constante o aumentará, nunca disminuirá. Esta Ley es particularmente importante en la Termodinámica, ya que establece que ningún sistema puede convertir toda la energía almacenada en él en trabajo útil. Esto significa que un sistema siempre tendrá una cantidad de energía no utilizable, la cual se conoce como energía residual. Esta Ley también establece que los procesos espontáneos siempre aumentan la entropía total del sistema. Esto significa que los procesos espontáneos siempre conducen a un estado de desorden mayor. Esta Ley es una de las leyes fundamentales de la Termodinámica y es aplicable a todos los sistemas, tanto naturales como artificiales.
Visualizando la segunda ley de la termodinámica
La segunda ley de la termodinámica es una ley fundamental de la física que describe la dirección en la que un proceso termodinámico se lleva a cabo. Establece que la entropía de un sistema aislado siempre aumenta o al menos permanece constante. Esta ley se basa en el principio de conservación de la energía, la entropía y la energía libre. Esta ley se aplica a los sistemas físicos, químicos, biológicos, informáticos y económicos, entre otros.
Visualizar la segunda ley de la termodinámica significa entender cómo se relacionan el calor, los procesos termodinámicos y la entropía. Esto implica una comprensión de cómo la energía se transforma de una forma a otra en un sistema cerrado. También significa entender cómo los procesos termodinámicos se ajustan para mantener el equilibrio térmico.
Uno de los conceptos clave relacionados con la segunda ley de la termodinámica es el principio de entropía. Establece que el calor fluirá de un objeto a otro hasta que alcancen la misma temperatura. Esto significa que la entropía de un sistema aislado siempre aumentará con el tiempo, ya que el calor se moverá hacia el objeto de menor temperatura. Esto también significa que los procesos termodinámicos tenderán a desacelerarse con el tiempo.
Otro concepto relacionado con la segunda ley de la termodinámica es la energía libre. Esta es la energía que queda en un sistema después de que se haya producido un cambio. Esta energía es la que se usa para realizar trabajo útil. La energía libre aumenta cuando se lleva a cabo un proceso termodinámico y disminuye cuando se lleva a cabo un proceso de descomposición. Esto significa que el calor se libera cuando los procesos termodinámicos se llevan a cabo, y se absorbe cuando se descomponen.
La segunda ley de la termodinámica es una ley fundamental de la física que describe el comportamiento de los sistemas termodinámicos. Visualizar esta ley implica comprender cómo se relacionan el calor, los procesos termodinámicos y la entropía. Esto también implica comprender cómo los procesos termodinámicos se ajustan para mantener el equilibrio térmico. Finalmente, al entender esta ley, también es importante entender el principio de entropía y la energía libre.
Tercera Ley de la Termodinámica
La Tercera Ley de la Termodinámica es una ley básica que se enuncia como sigue: «En un sistema aislado, la entropía se acerca a un valor constante en el límite de baja temperatura». Esta ley es una de las principales leyes de la termodinámica, una rama de la física que estudia los intercambios de energía entre los sistemas físicos.
La Tercera Ley de la Termodinámica explica la relación entre la temperatura absoluta y la entropía. La entropía se entiende como una medida de la desorganización en un sistema, y se puede ver como una medida del número de estados posibles para el sistema. Esta ley establece que para un sistema aislado, la entropía se acerca a un valor constante en el límite de baja temperatura, lo cual significa que la desorganización de un sistema se reduce al mínimo a temperaturas cercanas al cero absoluto. Esta ley también explica por qué los procesos físicos y químicos tienden a disminuir su entropía a temperaturas bajas.
La Tercera Ley de la Termodinámica también establece que la entropía de un sistema en el cero absoluto es una constante, que se denomina entropía cero. Esta es una cantidad absoluta que se utiliza para comparar la entropía de los sistemas a temperaturas mayores que el cero absoluto. Esta ley es importante para el estudio de los fenómenos físicos y químicos en los sistemas termodinámicos, ya que proporciona una medida para evaluar la entropía de los sistemas.
Ejemplos de la tercera ley de la termodinámica:
La tercera ley de la termodinámica, también conocida como «ley de los estados de entropía cero», establece que el entropía de un sistema en equilibrio termodinámico tiende a cero a la temperatura absoluta cero. Esta ley explica por qué el calor no se puede transferir espontáneamente desde un cuerpo frío a uno más caliente. La termodinámica es una rama de la física que estudia los efectos y relaciones entre la energía, el trabajo y el calor.
Algunos ejemplos de la tercera ley de la termodinámica son:
• Cuando se enfría una sustancia a temperaturas cercanas a cero absoluto (-273 °C), su entropía se acerca a cero.
• Cuando los sistemas se encuentran en equilibrio térmico, su entropía no cambia.
• La entropía de un sistema aislado aumenta en un proceso natural.
• La entropía se maximiza en los estados de equilibrio.
• En la temperatura absoluta cero, la entropía de un sistema es cero.
• Si un proceso es reversible, su entropía no cambia.
• La entropía de un sistema aumenta con el aumento de la temperatura.
Por lo tanto, la tercera ley de la termodinámica establece que la entropía de un sistema en equilibrio es cero a temperatura absoluta cero. Esto significa que, a temperaturas cercanas a cero absoluto, el calor no se puede transferir espontáneamente de un cuerpo frío a uno más caliente. Esta ley es fundamental para comprender el comportamiento de los sistemas en un estado de equilibrio.
Ejemplos de termodinámica en la vida diaria
La termodinámica es una rama de la física que estudia la relación entre la energía y el trabajo. Se trata de la ciencia que estudia los cambios de energía en un sistema físico, así como la transferencia de energía entre los distintos sistemas. Esto se hace para estudiar los cambios de temperatura, presión, volumen, entropía y otras propiedades de un sistema.
La termodinámica en la vida diaria se encuentra en casi todos los aspectos de la vida cotidiana. Por ejemplo, cuando se cocina con un horno, el calor transferido desde el horno a los alimentos es un ejemplo de termodinámica. El proceso de calentamiento de los alimentos es un intercambio de energía entre el horno y los alimentos. Otro ejemplo es cuando se enciende una lámpara, donde el calor generado por la lámpara es una transferencia de energía desde la lámpara al ambiente.
Otro ejemplo común de termodinámica en la vida diaria es el uso de un refrigerador. Los refrigeradores transfieren calor desde el interior del refrigerador al exterior. Esto se logra mediante el uso de un compresor que comprime el gas refrigerante en el interior del refrigerador. Esto aumenta la temperatura del gas, lo que permite que el calor se transfiera desde el interior del refrigerador al exterior.
Por último, la termodinámica también se puede ver en el funcionamiento de los motores. Los motores funcionan mediante la combustión de combustible, lo que genera calor. El calor generado se transfiere al combustible, lo que hace que el combustible se expanda, lo que a su vez genera presión y, finalmente, movimiento. Esta transferencia de calor hace posible que los motores funcionen.
Termodinámica: resumen y descripción general
.
Termodinámica: La termodinámica es la ciencia que estudia los cambios en la energía de un sistema. Esta energía se puede transformar de un estado a otro, como la energía cinética, el calor, la energía eléctrica, la energía potencial, etc. La termodinámica también estudia la manera en que estas transformaciones se relacionan con los cambios en la temperatura, presión, volumen, entropía y propiedades termodinámicas similares. La termodinámica se ocupa de los principios generales que rigen estas transformaciones, como la Ley de Conservación de la Energía, la Ley de Enfriamiento de Newton, y la Ley de los Estados Estacionarios. Estos principios son aplicables a una amplia gama de sistemas, desde los microscópicos hasta los enormes, desde los estáticos hasta los dinámicos. La termodinámica ayuda a explicar cómo los sistemas se comportan bajo diferentes condiciones, y es una herramienta vital para entender los procesos físicos y químicos.
¿Cuál es la importancia de las leyes de la termodinámica?
Las leyes de la termodinámica son un conjunto de principios que describen los procesos físicos involucrados en el intercambio de energía entre sistemas. Estas leyes establecen los límites para el comportamiento de los sistemas y proporcionan una herramienta para predecir su comportamiento. Las leyes de la termodinámica se aplican a muchos campos de la física, incluyendo la mecánica, la termodinámica, la química, la física nuclear y la astronomía.
La primera ley de la termodinámica, también conocida como ley de la conservación de la energía, establece que la energía de un sistema cerrado permanece constante. Esto significa que la energía no puede ser creada ni destruida, sino que sólo puede cambiar de forma. Esta ley se aplica a todos los sistemas, desde los sistemas físicos hasta los sistemas biológicos.
La segunda ley de la termodinámica establece que la entropía de un sistema aumenta con el tiempo, es decir, que el desorden aumenta con el tiempo. Esta ley explica por qué todos los procesos en la naturaleza tienden hacia el desorden. Esta ley también se aplica a los fenómenos físicos, químicos y biológicos.
La tercera ley de la termodinámica establece que la entropía de un sistema a temperatura absoluta cero es una constante. Esta ley se aplica a los sistemas que están en equilibrio, lo que significa que la entropía no cambia con el tiempo. Esta ley es útil para predecir el comportamiento de los sistemas que se encuentran a temperaturas cercanas a cero.
En general, las leyes de la termodinámica proporcionan un marco para predecir y comprender el comportamiento de los sistemas físicos. Estas leyes se aplican a una amplia variedad de campos, desde la mecánica hasta la química. Estas leyes también se utilizan para entender el comportamiento de los sistemas biológicos, lo que puede ayudar a explicar el origen de la vida.
¿Cuál es un ejemplo de trabajo negativo?
La Termodinámica es la ciencia que estudia los cambios en la energía y el comportamiento de los sistemas físicos sometidos a la influencia de los procesos de transferencia de energía. Un ejemplo de trabajo negativo en termodinámica sería el proceso de refrigeración térmica o refrigeración por absorción. Esto implica la transferencia de energía desde una fuente fría a una fuente caliente. La energía cinética se transfiere desde la fuente fría a la caliente, lo que resulta en una disminución del movimiento de las partículas en la fuente fría. Esto es un proceso de transferencia de energía denominado trabajo negativo. El trabajo negativo se realiza cuando el sistema se enfría y el resultado es el movimiento de partículas de la fuente fría a la caliente. Esto resulta en una disminución de la energía cinética de la fuente fría y un aumento de la energía cinética de la fuente caliente.
¿Se puede destruir o perder la energía?
¿Se puede destruir o perder la energía?
La respuesta es sí, se puede perder. La energía nunca se destruye, simplemente cambia de forma. Esto es lo que se conoce como ley de conservación de la energía, que es un principio de la termodinámica. Esto significa que la energía se transfiere de un objeto a otro y se transforma de una forma a otra, pero no se crea ni se destruye.
La energía se puede perder a través del calor, el trabajo, la radiación electromagnética, etc. Esto se debe a que los sistemas no son perfectamente eficientes. Estas pérdidas son inevitables y son una parte importante de la termodinámica. La ley de conservación de la energía se refiere a la cantidad de energía total en un sistema. Por lo tanto, se pueden perder cantidades pequeñas de energía, pero la cantidad total de energía en el sistema no se altera.
La segunda ley de la termodinámica se refiere a la eficiencia con la que se transfiere y utiliza la energía. Esta ley indica que cuando la energía se transfiere de un sistema a otro, siempre hay una pérdida de energía. Esta pérdida de energía se conoce como entropía. La entropía es una medida de la disipación de energía, que se refiere a la cantidad de energía perdida durante el proceso.
Por lo tanto, aunque la energía no se destruye, se puede perder. Esto se debe a que los sistemas no son perfectamente eficientes, y hay una cantidad de energía que se pierde como entropía durante los procesos de transferencia y uso de energía. La ley de conservación de la energía se refiere a la cantidad total de energía en un sistema, mientras que la segunda ley de la termodinámica se refiere a la eficiencia con la que se transfiere y utiliza la energía.
Los ventiladores convierten la energía eléctrica en energía mecánica. ¿Qué ley explica esto?
La Ley de Termodinámica de la Transformación Adiabática o Ley de Joule explica cómo los ventiladores convierten la energía eléctrica en energía mecánica. Esta ley es una de las cuatro leyes básicas de la termodinámica, que estudia la relación entre la energía, el trabajo y la temperatura. Según esta ley, la energía se conserva durante una transformación adiabática, es decir, sin cambio de temperatura, pero puede transformarse en otro tipo de energía.
En el caso de los ventiladores, la energía eléctrica se convierte en energía mecánica, es decir, en movimiento, gracias al principio de la Ley de Joule. Los ventiladores están formados por un motor eléctrico, una hélice o algún otro dispositivo mecánico, que genera el movimiento necesario para mover el aire. El motor eléctrico se alimenta de corriente eléctrica, que es transformada en energía mecánica, permitiendo así el movimiento de la hélice.
La Ley de Joule es el principio básico de la termodinámica que rige la transformación de la energía eléctrica en energía mecánica, y es la ley que explica el funcionamiento de los ventiladores.
¿El cuerpo humano obedece las leyes de la termodinámica?
.
¿El cuerpo humano obedece las leyes de la termodinámica? La termodinámica es una rama de la Física que se encarga de estudiar las relaciones entre el calor y la energía mecánica. Esta ciencia también estudia los cambios de estado en los sistemas mecánicos, así como la forma en que se transfiere la energía entre los mismos.
El cuerpo humano es un sistema mecánico compuesto por órganos y tejidos que interaccionan entre sí para mantener un balance de energía. Esta energía se obtiene a partir de la alimentación y el descanso. Por lo tanto, el cuerpo humano obedece las leyes de la termodinámica, ya que los cambios de estado en el cuerpo se relacionan con los cambios de energía en el sistema.
Además, el cuerpo humano está compuesto por un sistema de órganos que interactúan entre sí para mantener un balance de energía. Esto significa que el cuerpo humano se comporta como un sistema cerrado, en el que la energía entra y sale, pero el balance de energía dentro del sistema se mantiene constante. Por lo tanto, el cuerpo humano obedece las leyes de la termodinámica, ya que los cambios de energía en el sistema se relacionan con los cambios de estado en el cuerpo.
Por lo tanto, es seguro decir que el cuerpo humano obedece las leyes de la termodinámica. Estas leyes rigen el comportamiento de los sistemas mecánicos, incluidos los cuerpos humanos. Esto significa que los cambios de estado en el cuerpo se relacionan con los cambios de energía en el sistema. De esta forma, el cuerpo humano obedece las leyes de la termodinámica.
José Cernicharo Quintanilla fue un físico matemático español que nació en 1952. Se graduó en la Universidad Complutense de Madrid con un doctorado en Física en 1980. Después de su graduación, trabajó como investigador en el Instituto de Estructura de la Materia en Madrid. Allí realizó trabajos fundamentales en Física Teórica, especialmente en el campo de la mecánica cuántica. Sus descubrimientos han ayudado a desarrollar la teoría de la relatividad y la teoría cuántica. También fue miembro de la Real Academia de Ciencias de Madrid.